Alveoláris puha rész Sarcoma
Az alveoláris lágyrész szarkóma (ASPS) az ismeretlen hisztogenezis ritka, rossz prognózisú daganata, amely megkülönböztető szövettani, specifikus molekuláris jellemzőkkel és egyedülálló klinikai viselkedésekkel rendelkezik. Az ASPS általában fiatalabb betegeknél alakul ki. Ellentétben a lágyszöveti szarkómákkal, az ASPS metasztatizálja az agyat is. Míg a műtét az áttétes betegség kialakulásában is javíthatja a kimeneteleket, a hagyományos kemoterápiás szerek és / vagy sugárterápia nem mutatott szignifikáns túlélési előnyöket. Ez a cikk áttekintést nyújt az ASPS klinikai tüneteiről, diagnózisáról, röntgenfunkcióiról és kezeléséről.
Háttér
Az alveoláris lágyrész szarkóma (ASPS) egy külön szövettani lágyrészszarkóma altípus. 1 Az ASPS nem gyakori daganat, amely rendszerint fiatal és felnőtt betegeknél fordul elő. Az összes lágyrészszérum 0,5-1% -át teszi ki. Viszonylag szívtelen daganat-növekedési mintázat ellenére a betegek 79% -áig metasztatikus betegség alakul ki, és nagy arányban rezisztensek a hagyományos kemoterápiás kezelésekhez. A terápiásán rezisztens metasztázisok kialakulása hozzájárul a megnövekedett mortalitáshoz.
Az ASPS eredeti leírása hagyományosan Christophersonhez, majd a sebészi patológiában a Memorial Sloan Kettering Cancer Center-be kerül. A 12 eset 1952-ben végzett tanulmányának közzétételével Christopherson és mtsai. létrehozta az “alveoláris lágyrész szarkóma” leíró kifejezést egy egyedi lágyszöveti daganat számára. 1 Ezt a tumort először szövettani szempontból meghatározott fészkekben (“alveolusok”) elhelyezett sejtek jelenlétével választották el, amelyeket szétválasztott endotéliummal szegélyezett szinuszos érrendszeri csatornákat tartalmazó kötőszövetek kényes elválasztása választ el. 1 Christopherson publikációját megelőzően az ASPS szervezetét számos más név, köztük a “rosszindulatú myoblastoma”, a “szemcsés sejtmikroblastoma” és a “rosszindulatú granuláris sejtmikobóma” írta le. 2-6 Míg Christopherson és mtsai. nem írta le azokat az intracitoplazmatikus kristályszerkezeteket, amelyek az ASPS egyik meghatározó elemévé váltak, de Dr. Pierre Masson nem publikált levelet írt, aki megjegyezte az intracitoplazmatikus kristályokat. Ezért az intracitoplazmatikus kristályokért való elismerés Dr. Massonhoz tartozik, aki később 1956-ban tanulmányt tett közzé ezen struktúrák ultrastrukturális megjelenéséről. 7 Christopherson és munkatársainak ismeretlen, az ASPS-et Smetana és Scott egy évvel korábban írta le, mint a nem chromaffin paraganglia rosszindulatú daganatait. 8 Ezt a kifejezést választották, mert a daganatok nem fiziológiailag aktív paragangliákhoz hasonlítottak, feltételezve, hogy a primitív paraganglia-szerű struktúrák rendszerint előfordulhatnak a szomatikus lágyrészekben (ez a hipotézis később diszkreditált). Smetana és Scott szintén önállóan figyelték meg az ASPS intracitoplazmatikus kristályait, leírva őket rúd alakú, durva, ismeretlen eredetű bazofil testekként. 8
Klinikai manifesztációk
Az ASPS általában lágy, fájdalommentes, lassan növekvő tömegként jelenik meg, amely ritkán okoz funkcionális károsodást. Felnőtteknél az alsó végtagok a leggyakoribb fekvés ezen elváltozás, bár számos helyen, köztük a női nemi szervekben, a mediastinumban, a mellben, a húgyhólyagban, a gyomor-bélrendszerben és a csontban leírtak. 9-11 Gyermekeknél az ASPS leggyakrabban a fej és nyak régiójában fordul elő. 9, 10 Ezek a tumorok rendkívül érrendszeriek, és alkalmanként pulzáló masszákként jelenhetnek meg egy kapcsolódó gyümölccsel.
 1. ábra: A: 26 éves nő fejének CT-vizsgálata.
1. ábra: A: 26 éves nő fejének CT-vizsgálata.
A tünetek relatív hiánya miatt sok betegnél a tumor könnyen megfigyelhető, és a tüdőbe vagy más helyekre történő metasztázisok lehetnek az első betegség manifesztáció. A leggyakoribb metasztatikus helyek a tüdő, a csont, a központi idegrendszer és a máj. 11 Metasztázist jelentettek mindaddig, amíg a tumor kezdeti reszekciójától számított 15 év. A lágyszöveti szarkómától eltérően az ASPS az agyba is áttételt mutat, és az metasztatikus ASPS közös jellemzőjeként írják le (1. ábra). 11,13-15 A Texas At University Egyetem MD Anderson Cancer Center 70 kezelt ASPS-betegének áttekintése kimutatta, hogy az agyi metasztázisok szinte mindig kimutathatók metasztatikus betegséggel együtt más helyeken. 11
Alveoláris puha rész szarkóma diagnosztizálása
Radiológiai eredmények
Ennek a szokatlan daganatnak a pontos diagnosztizálása és kezelése magas klinikai gyanú mutatót igényel, és megfelelő röntgenvizsgálatokkal klinikopatológiai korrelációval párosul. Ha a klinikai vagy radiográfiai értelmezés kétértelmű, a korai biopszia elengedhetetlen az alveoláris lágyrész szarkóma differenciálódásához az arteriovenosus malformációból. Az ASPS tumorok hipervaszkulárisnak tűnnek angiográfiával és CT-vel (CT), sűrű tumorfoltot és kanyargós, dilatált elvezető ereket. 16
Az ASPS diagnózisa különböző orvosokból álló orvosokat igényel, például radiológusokat (orvosokat, akik orvosi képeket szereznek és értelmeznek), patológusok (orvos, aki értelmezi és diagnosztizálja a betegségek által okozott változásokat a szövetekben és a testfolyadékokban), sebész onkológusokat ( orvos, aki foglalkozik a rák sebészeti beavatkozásával), és az orvosi onkológusok (orvos, aki kemoterápiát használ a rák kezelésére).

2. ábra. Egy 50 éves, egy nagyméretű úriember CT-vizsgálata.
A 2. ábra egy 50 éves, 10 cm-es átmérőjű ASPS-nek az elülső alsó mellkasfalról származó CT-vizsgálatát mutatja be. A képen lévő daganat a központi nekrózis magját körülvevő vaszkuláris perifériát mutat.
A mágneses rezonancia képalkotás tipikusan a tumor magas jelintenzitását mutatja mind a T1-, mind a T2-súlyozott képeken. 17 Háromfázisú csontvizsgálat 26,4 mCi és Tc-99m oxidronát-nátrium (Tc-99m HDP) beadásával is alkalmazható a daganatos érrendszeri megbetegedések kimutatására kiválasztott esetekben. 18
Patológiai megállapítások
A tumor mérete általában 3-8 cm közötti, de az ASPS legfeljebb 20 cm-es eseteket jelentettek. Makroszkóposan a tumorszövet halványszürke vagy sárgás színű, puha konzisztenciájú (3. ábra).

3. ábra Keresztmetszet egy resectált primer ASPS tumorról.
A nagyobb elváltozásokban gyakoriak a nekrózis és a vérzés. A szisztolés vizsgálat szerint az ASPS tumorok jól meghatározott fészkekből állnak, melyeket finom fibrovaszkuláris septae választ el (4A. Ábra). Ezeken a fészkekben a sejtes kohézió kiemelkedő hiánya van, amely a megkülönböztető pszeudo-alveolaris mintát jelenti, amelyre ez a betegség szerepel. 19 Az ASPS variánsát figyelték meg olyan fiatal pácienseknél, akiknél a lingvális ASPS volt, amelynek szilárd, nem alveoláris növekedési mintázata gyengébb előfordulási aránya a tipikus celluláris disszociációnak a nem-nyelvű ASPS-ben megfigyelhető. Az intravaszkuláris kiterjedés a tumor perifériáján szinte minden esetben jelen van, és számíthat az ASPS-ben megfigyelt magas metasztázisra (4B. Ábra).
A sejtek gyakran tartalmaznak eozinofil kristályos vagy rúd alakú zárványokat, amelyek gyengén láthatóak a hematoxilin-eozin által kivágott szövetrészekben. Periódsav-Schiff (PAS) foltok esetében intracitoplazmatikus glikogén és jellegzetes PAS-pozitív, diasztázzal szemben rezisztens rombusz vagy rúd alakú kristályok jelen lehetnek (4C. Ábra, D). Tipikus kristályos anyagot találunk az esetek legalább 80% -ában, és a PAS-pozitív granulátumok szinte minden daganatban jelen vannak. Kimutatták, hogy az ASPS kristályos citoplazmatikus granulátuma az monokarboxilát transzporter 1-et és a CD147-et tartalmazza. Ultrastrukturálisan az ASPS sejtek számos mitokondriummal rendelkeznek, kiemelkedő sima endoplazmatikus retikulummal, glikogénnel és jól fejlett Golgi-készülékkel.

4. ábra: Az ASPS esetének hematoxilin-eozin festése.
Az ASPS egy másik jellegzetes ultrastrukturális jellemzője a membránhoz kötött vagy szabad rombusz, rúd alakú kristály, amely merev szálakból áll (4D. Ábra). Ezek a tumorok szintén desmint, egy köztes szálat fejeznek ki. Kimutatták, hogy a tumorok körülbelül 50% -a expresszálja a desmint. Fontos hangsúlyozni, hogy a desmin expresszió számos egyéb károsodás, például melanoma, Ewing-szarkóma és angiomatoid malignus fibrous histiocytoma széles körében is megfigyelhető.
Az ASPS gyakran diagnosztikai kihívást jelent. A neoplasztikus sejtek epithelioid megjelenése és pszeudoalveoláris növekedési mintázatuk miatt az ASPS sokféle neoplasztikus állapotot, például metasztatikus vesesejt karcinóma, paraganglióma, granulátumsejtes tumor és melanoma lehet. 21 Az esetek többségében a klinikai megjelenés, valamint a PAS-pozitív diasztázis-rezisztens kristályok bemutatása elegendő lesz a diagnózis felállításához. Alkalmanként az intracitoplazmatikus kristályok nincsenek jelen. Ezekben az esetekben a jól körülírt Golgi komplexek jelenléte, amelyek sok kis granulát tartalmaznak és körülötte hasznos segítséget nyújtanak a megfelelő klinikai kontextusban. 21

5. ábra Alveoláris puha rész szarkóma (ASPS) transzlokáció. .
Az immunhisztokémiai analízis hasznos eszköz a differenciáldiagnózis kialakításában. Például a vesesejtes karcinóma az ASPS-től megkülönböztethető erős citokeratin expressziójával. Ezenkívül a vesesejt karcinóma intracitoplazmatikus kristályokat vagy Golgi komplexeket nem tartalmaz kis sűrű maggranulátumokkal. Az ASPS nyelvi daganatok gyakran nagyon kis sejtfészkeket mutatnak be, amelyek szorosan imitálják a valódi paragangliómákat. 20 E két entitást meg lehet különböztetni, hogy a paragangliómák erős reaktivitást mutatnak a kromogranin és a szinaptofizin számára, és negatívak a dezminhez. 9
A szemcsés daganatok különböznek az ASPS-től számos szemcsés anyagú lizoszómák és a kristályok hiánya miatt. 22 A melanóma megkülönböztethető az ASPS-től a premelanoszómák jelenléte és a kristályok hiánya miatt. 9
Molekuláris analízis
Az ASPS-t tumor-specifikus transzlokáció jellemzi: der (17) t (X; 17) (p11; 25). Ez a transzlokáció az Xp11.22-ben található TEF3 transzkripciós faktor fúzióját eredményezi egy új génnel a 17q25 nevű ASPL néven ismert ASPSCR1-sel (5. ábra).
Bővebben az 5. ábráról
A panel: A nem kölcsönös fúziós események a legtöbb szarkóma esetében nem gyakoriak, de az ASPS-ben dominálnak, amint azt a (A jobb felső részén) illusztráljuk.
Exon 3-8 vagy 4-8: Az ASPSCR1 (17q25; kék) töréspontja, korábban ASPL, invariáns. Ez az 1. és 2. típusú fúziós transzkriptumokat ábrázolja. A 2. típus tartalmazza a TFE3 aktivációs doménjét, míg az 1. típus nem, de mindkettő olyan új transzkripciós faktorokat képez, amelyek a TFE3 DNS-kötő doménjét tartalmazzák az ASPSCR1 aktivációs doménjével és funkcionálisak. A fehérje vagy a klinikai eredmények különbségeit nem írják le; az 1. típusú fúziós események gyakrabban fordulhatnak elő, mint a 2. típusúak, de csak néhány esetet jelentenek.
Ez a jellegzetes transzlokáció az X és a 17 kromoszómák között olyan funkcionális transzkripciós faktort eredményez, amely módosított célgén aktivációval jár, ami transzkripciós deregulációt jelent a tumor patogenezisében. 23 A transzlokáció egy új ASPL-TFE3 fúziós fehérjét hoz létre, amely úgy tűnik, hogy rendellenes transzkripciós faktorként működik, ami a TFE3 szabályozott gének szabályozatlan transzkripcióját indukálja.

6. ábra Egy egységes és erős atomot demonstráló ASPS.
Kimutatták, hogy az ASPL-TFE3 transzlokációval rendelkező tumorok TFE3-at expresszálnak (6. ábra). Ennek következtében a TFE3 nukleáris kifejezés kimutatása hasznos az ASPS diagnózisának megállapításához.
A radikális reszekció a lokalizált betegség választásának terápiája. 14,25 A lokális rekurenciális arányok 11-50% -os tartományba esnek. 10,11 A teljes mikroszkopikus R0 reszekció elérése kritikus a lokális alveoláris lágyrész szarkóma esetében, de a hiányos felismerés hiánya miatt a hiányos kivágás túl gyakran fordul elő. Annak ellenére, hogy a metasztázisok a betegek 79% -ánál fordulnak elő, az ötéves túlélési arány 45-88% között mozog. 10,11,26-28 A hagyományos kemoterápia, sugárzás vagy kivágás alkalmazásával nem sikerült szignifikáns túlélési előnyöket elérni azoknál a betegeknél, akiknél az eredeti diagnózis idején a metasztázisok bizonyítékai voltak a nem kezelt betegekhez képest. 10,11
Intézményünkben az áttétes ASPS-es betegeket egyedileg értékeljük. Az ASPS hagyományos kemoterápiához való rezisztenciája miatt javasoljuk, hogy ezeket a betegeket megfigyeljük, vagy a klinikai vizsgálatokba való beiratkozást új terápiákként kezeljük potenciális kezelésként. Mint azt korábban jeleztük, néhány olyan beteg, akik később kifejlődtek metasztázistémával kezelt tüdőmetasztázisok (sugárkezeléssel vagy anélkül), a medián túlélés növekedésével hasonlították össze a kivágással nem kezeltekhez képest (218 hónap, szemben a 63,5 hónapdal). Ugyanakkor, mivel ez a megfigyelés kis számú betegen alapult, ennek további vizsgálatára van szükség. Salvati et al. beszámoltak egy olyan vizsgálatról, amely három ASPS-beteget érintett, akiknél az ASPS agymetasztázisainak sebészeti eltávolítása, majd radioterápia és / vagy kemoterápia történt. Az ASPS-ben szenvedő három páciens közül kettő 15 és 20 hónapos életkorban élt, míg a harmadik páciens 24 hónapos követést követően élt. 29 A betegek korlátozott számának köszönhetően kihívást jelent, hogy meggyőző nyilatkozatot tegyenek az ASPS agymetasztázis reszekciójának szerepéről. A metasztáziságot olyan betegeknél vizsgáljuk, akiknek jó állapotuk van, és működő tumorok, amelyek teljesen elfogadható morbiditást mutatnak.
Új célzott terápiák

Bár a műtét az áttétes betegség kialakulásában is javíthatja a kimeneteleket, a hagyományos kemoterápiás szerek és / vagy sugárterápia nem eredményezett jelentős túlélési előnyöket. 30, 31 Az egyéb lágyszövetek szarkómáinak kezelésére használt kemoterápiás kezelések általában nincsenek hatásosak az ASPS-ben. A közelmúltban a szisztémás rákterápiák középpontjában a molekulárisan célzott kezelések alkalmazására koncentráltak, nem pedig a nem specifikus citotoxikus szerek mellett. Ez a változás az orvosi menedzsmentben arra késztette a kereske- delmet, hogy a gyógyszeres gátlásra alkalmas, általánosan kifejezett deregulált célokat keresse és azonosítsa. Például értékeltük az ASPS-ben potenciális célpontok kifejeződését a koncentrált ASPS szöveti mikroarray alkalmazásával. 32 Ezzel az egyedülálló biorezforrással bizonyítottuk, hogy a c-Met receptor és annak downstream effektjei (például AKT és ERK) aktiválódnak az ASPS-ben.
A c-Met receptorhoz (MET) kódoló gént nemrégiben ASPL-TFE3 transzkripciós célként azonosították, 33 Ezt a gént a TFE3 szabályozza, ami a c-Met fehérje megnövekedett termelését eredményezi. A c-Met receptor aktiválása és a downstream jelátvitel bizonyítottan elősegíti az angiogenezist (véredények növekedését), proliferációt, túlélést, sejtmozgást és invazivitást a tumorsejtekben, és hozzájárulhat az ASPS malignus progressziójához. Ezért a c-Met értékelése további figyelmet szentel.
c-Met és célzott kezelés
c-Met egy tirozin kinázreceptor. Mind a c-Met, mind annak liganduma, a hepatocita növekedési faktor (HGF) mindegyike normál emlősök fejlődéséhez szükséges, és kimutatták, hogy különösen fontos a sejtek vándorlása, a morfogén differenciálódás és a háromdimenziós csöves szerkezetek, valamint a sejtnövekedés és angiogenezis. Mind a c-Met, mind a HGF bizonyítottan deregulálódott számos jelentős emberi rákban. A c-Met és a HGF ellen irányuló új gyógyszereket jelenleg vizsgálnak in vitro és in vivo, ígéretes eredményekkel. Ezek a gyógyszerek különböző lépésekben működnek, beleértve a c-Met expresszálást az RNS vagy fehérje szintjén, a ligand-receptor kölcsönhatás és a tirozin kináz funkció.
A II. Fázisú klinikai vizsgálat során az ASPS-betegek kezelésére ARQ 197-t, egy új c-Met inhibitort alkalmaztak. A kísérletre vonatkozó előzetes adatokat az ASCO 2009-ben mutatták be, jelezve, hogy összesen 28 beteg – közülük 17-nek volt ASPS-kezelése ARQ 197-gyel. 15 ASPS-ben szenvedő beteg bizonyult stabil betegségnek a legfeljebb 29 + hetet meghaladó időtartamra. A hatásosság szempontjából értékelhető 20 beteg közül 5% -os általános válaszarányt és 80% -os betegségellenőrzési arányt (CR + PR + SD) mutattak ki. Ezenkívül az ERK és az AKT útvonalak aktiválása is előfordulhat az aktivált c-Met receptoron kívüli tényezők stimulálásával. Jelenleg egy II. Fázisú vizsgálatot végeznek a KRX-0401 (perifozin), egy AKT inhibitor, ASPS-betegek alkalmazásának értékelésére.
Az ASPS prominens vascularitása miatt a proangiogén gének expresszióját vizsgáltuk angiogenesis oligomikroarákon keresztül [28], amelyek azt bizonyították, hogy tizennyolc angiogenezishez kapcsolódó gént lehet felismerni az ASPS-ben korrigáltnak. Ezen megállapítások kiegészítéseként számos csoport demonstrálta az antiangiogén megközelítés megvalósíthatóságát az ASPS kezelésében, in vivo preklinikai ASPS 34,35 modell alkalmazásával, antiangiogén megközelítések, például bevacizumab értékelésére. Emellett a Cediranib (AZD2171), a VEGF / KIT tirozin-kináz inhibitor, amely meggátolja az új erek kialakulását, nemrég úgy találták, hogy tumorellenes aktivitással rendelkezik korai fázisú klinikai vizsgálatokban, amelybe néhány ASPS-beteg volt; egy II. fázisú vizsgálat, amely a Cediranib alkalmazását értékeli az ASPS-ben szenvedő betegek kezelésében, jelenleg aktív, de már nem szed fel betegeket.
A közelmúltban figyelemreméltó másik megközelítés a tirozinreceptor-inhibitorok alkalmazása, ahol az alapjául szolgáló indokolás az aktivált tirozin-kináz receptorok (TKR), például a PDGFR, az EGFR, a MET család és az ASPS-ben megfigyelt RET magas szintjén alapul. Egy öt vizsgálatban négy, fejlett ASPS-ben szenvedő beteget kezeltek a szunitinib-maláttal, egy tirozin kináz receptor inhibitorral, amely közvetlen daganatellenes és antiangiogén aktivitást célzott PDGFR, KIT, FTL3, VEGFR és RET. 36 A négy beteg közül, akiket válaszként értékeltek, két beteg részleges reakciót mutatott, egy beteg stabil betegséget mutatott, míg a másik előrehaladt. Jóllehet ezek az adatok nagyon előzetesek, a megfigyelések ígéretesek és a szunitinib-malát bizonyos ASPS-hatékonyságát sugallják. Számos jelentés bizonyította a TKR-gátlók, például a Nexavar (Sorafenib) potenciális alkalmazását ASPS-betegeknél.
Felügyelet
Nyomon követés a lokalizált betegségben szenvedő betegeknél
A betegeket éveken át egy tapasztalt onkológusnak kell követnie, mind a megismétlődés kockázatát, mind a terápia mellékhatásainak kockázatát illetően. Az ASPS sok év elteltével megismétlődhet vagy növekedhet a diagnózis után, és még akkor is, ha a műtét nyilvánvalóan “betegségmentes” állapotot eredményezett. Hosszú távú nyomon követés, beleértve az eredeti betegség és a tüdő helyeinek értékelését. A felügyeleti vizsgálatok ütemezésére és típusára vonatkozó egyedi ajánlatok a pácienstől függően változnak, és figyelembe kell venni a sugárzás ismételt expozíciójának kicsi, de nem elhanyagolható kockázatát. Az ASPS ismétlődése a műtétre alkalmas. 37
Metasztatikus betegségben szenvedő betegek nyomon követése
Habár az ASPS kiterjedt szövetek széles skálájára terjedhet, a tüdő továbbra is a megfigyelést igénylő fő hely marad. A megfigyelésnek egy klinikus által elvégzett történeti és fizikai vizsga, valamint mellkasi képalkotásból kell állnia. 38 Kevés bizonyíték támasztja alá az ASPS-szel jelenlévő betegek rutinszerű intracranialis képalkotására vonatkozó ajánlást. 11 A koponyaűri képalkotást figyelembe kell venni, ha a tüdőmetasztázisok dokumentálva vannak, vagy neurológiai tünetek jelentkeznek. A hosszú távú túlélés akár metasztatikus betegség esetén is lehetséges. Az, hogy az ASPS-ben szenvedő betegeknél kisszámú metasztatektómia kedvező kimenetele a műtéti terápiának vagy a betegség indolens jellegének köszönhető-e, nincs meghatározva. Ezért nehéz megjegyezni a műtét szerepét az izolált metasztázisos ASPS-ben szenvedő betegeknél. Javasoljuk, hogy az áttétes ASPS-t egyedileg értékeljük, és vizsgáljuk meg a metasztáziságot azoknak a betegeknek, akiknek jó teljesítményük van, és olyan orvosilag működőképes tumorok, amelyek M1-es betegsége teljesen elfogadható morbiditást mutat.
Következtetések
Összefoglalva, az “alveoláris lágyrész sarcoma” leíró kifejezés olyan ritka lágyszöveti szarkóma szövettani altípusra utal, amely jellemzően fiatal betegeknél fordul elő. Ezt megkülönböztető hisztológiai megjelenés és specifikus molekuláris genetikai rendellenesség jellemzi; a prognózis gyenge. Egy adott ASPS kromoszómális transzlokáció azonosítása nemcsak kritikus információt szolgáltatott a betegség patogeneziséről, hanem racionális molekuláris célzott terápiás értékelést is eredményezett. A szakirodalomban közölt legtöbb sorozat azt sugallja, hogy az ASPS chemosensitivitása szerény, ezért a lokalizált betegségben a sebészeti beavatkozás jelentős szerepe van. A távoli metasztázisok előfordulása meglehetősen gyakori az ASPS-ben; még a legnagyobb, jelenleg publikált ASPS 10,11 klinikai sorozat sem határozza meg az áttétes ASPS-betegség optimális kezelését. Tapasztalataink alapján 11 a metasztatikus betegségben szenvedő betegek rutin szisztémás kemoterápiájának előnye bizonytalan.
Azonban a jelenlegi kezelési ajánlatok nagyon korlátozott klinikai információkon alapulnak. Időközben az új molekuláris célzott terápiák, mint például az antiangiogén megközelítések és a tirozin-kináz inhibitorok, az ASPS kezelésében a legígéretesebb új megközelítést tartalmazzák, amely pusztító daganat, amely sajnos úgy tűnik, hogy olyan betegeknél jelentkezik, akik egyébként csak a normális felnőtt élet.
Utolsó felülvizsgálat és orvosi felülvizsgálat: 12/2010
Által Keila E. Torres, PhD
Sebészeti onkológiai szakember a Sebészeti Onkológiai Tanszéken
A texasi Egyetem M. D. Anderson Rákközpontja, Houston, Texas
Raphael E. Pollock, PhD
Professzor és vezető, sebészeti osztály
A texasi Egyetem M. D. Anderson Rákközpontja, Houston, Texas
1. Christopherson WM, Foote FW, Jr., Stewart FW. Alveoláris lágyrész szarkómák; strukturálisan jellemző tumorok a bizonytalan hisztogenezisben. Cancer 1952; 5: 100-11.
2. Ackerman L, Phelps C. A gluteális régió malignus szemcsés sejtmikroblasztoma. Surgery 1946; 20: 511-9.
3. Horn R, Stout A. Granuláris sejt mioblasztóma. Surg Gynecol Obstet 1943; 76: 315-8.
4. Kanolkar V. Granuláris sejt mioblasztóma. Am J Pathol 1947; 23: 721-39.
5. Klempere P. Myoblastoma a csíkos izom. Am J Cancer, 1934: 324-37.
6. Ravich A, Stout A, Ravich A. A húgyhólyagot érintő malignus szemcsés sejtmobillastoma. Ann Surg 1945; 121: 361-72.
7. Masson P. Tumeurs humaines: hisztológia, diagnosztika és technikák. 2. szerk. ed. Párizs: Liberie Maloine; 1956.
8. Smetana H, Scott W. Nemchromaffin paraganglia malignus tumorai. Milit Surgery 1951; 109, 330-41.
9. Ordonez NG. Alveoláris lágyrész szarkóma: áttekintés és frissítés. Adv Anat Pathol 1999; 6: 125-39.
10. Lieberman PH, Brennan MF, Kimmel M, Erlandson RA, Garin-Chesa P, Flehinger BY. Alveoláris lágyrész szarkóma. Egy fél évszázados klinikai-patológiai tanulmány. Cancer 1989; 63: 1-13.
11. Portera CA, Jr., Ho V, Patel SR, et al. Alveoláris lágyrész szarkóma: klinikai tünetek és metasztázis mintázatok 70 betegben egyetlen intézményben. Cancer 2001; 91, 585-91.
12. Cordier JF, Bailly C, Tabone E, Cheix F, Brune J, Touraine R. Alveolar puha rész szarkóma tünetmentes pulmonalis nodulákként: ultrastrukturális diagnózis esetén. Thorax 1985; 40: 203-4.
13. Ogose A, Morita T, Hotta T. et al. Agyi metasztázisok az izom-csontrendszeri szarkómákban. Jpn J Clin Oncol 1999; 29: 245-7.
14. Salvati M, Cervoni L, Caruso R, Gagliardi FM, Delfini R. Sarcoma metasztatikusan az agyhoz: 15 esetben. Surg Neurol 1998; 49: 441-4.
15. Evans HL. Alveoláris lágyrész szarkóma. 13 tipikus példa és egy szövettanilag atipikus komponens vizsgálata. Cancer 1985; 55: 912-7.
16. Lorigan JG, O’Keeffe FN, Evans HL, Wallace S. Az alveoláris lágyrész szarkóma radiológiai manifesztációi. AJR Am J Roentgenol 1989; 153: 335-9.
17. Temple HT, Scully SP, O’Keefe RJ, Rosenthal DI, Mankin HJ. Alveoláris lágyrész szarkóma klinikai bemutatása. Clin Orthop Relat Res 1994: 213-8.
18. Zarrin-Khameh N, Kaye KS. Alveoláris lágyrész szarkóma. Arch Pathol Lab Med 2007; 131: 488-91.
19. Weiss SW, Goldblum JR. Enzinger és Weiss Soft Tissue Tumorok. Ötödik kiadás szerk. Philadelphia: Mosby Elsevier; 2008-ra.
20. Fanburg-Smith JC, Miettinen M, Folpe AL, Weiss SW, Childers EL. Nyelvi alveoláris lágyrész szarkóma; 14 eset: új klinikai és morfológiai megfigyelések. Histopathology 2004; 45: 526-
37.
21. Ordonez NG, Mackay B. Alveolar lágyrész szarkóma: a patológia és a hisztogenezis felülvizsgálata. Ultrastruct Pathol 1998; 22: 275-92.
22. Troncoso P, Ordonez NG, Raymond AK, Mackay B. Malignus szemcsés daganat: immuncitokémiai és ultrastrukturális megfigyelések. Ultrastruct Pathol 1988; 12: 137-44.
23. Ladanyi M, Lui MY, Antonescu CR, et al. A humán alveoláris lágyrész szarkóma der (17) t (X; 17) (p11; q25) a TFE3 transzkripciós faktor gént az ASPL-hez, egy új gént 17q25-re fuzionálja. Oncogene 2001; 20: 48-57.
24. Argani P, Lal P, Hutchinson B, Lui MY, Reuter VE, Ladanyi M. A TFE3 génfúziókkal kezelt neoplazmákban a TFE3 nukleáris immunreaktivitása: érzékeny és specifikus immunhisztokémiai vizsgálat. Am J Surg Pathol 2003; 27: 750-61.
25. Kayton ML, Meyers P, Wexler LH, Gerald WL, LaQuaglia MP. Az alveoláris lágyrész szarkóma klinikai megjelenése, kezelése és kimenetele gyermekeknél, serdülőknél és fiatal felnőtteknél. J Pediatr Surg 2006; 41: 187-93.
26. Auerbach HE, Brooks JJ. Alveoláris lágyrész szarkóma. Egy klinikopatológiai és immunhisztokémiai vizsgálat. Cancer 1987; 60: 66-73.
27. Nakashima Y, Kotoura Y, Kasakura K, Yamamuro T, Amitani R, Ohdera K. Alveolar lágyrész szarkóma. Tíz esetről szóló jelentés. Clin Orthop Relat Res 1993: 259-66.
28. Lazar AJ, Das P, Tuvin D, et al. Angiogenezis-elősegítő génminták alveoláris lágyrész szarkómában. Clin Cancer Res 2007; 13: 7314-21.
29. Salvati M, D’Elia A, Frati A, Santoro A. Sarcoma metasztatikus az agyhoz: 35 esetből és megfontolásokból 27 éves tapasztalattal. J Neurooncol; 98: 373-7.
30. Reichardt P, Lindner T, Pink D, Thuss-Patience PC, Kretzschmar A, Dorken B. Kemoterápia alveoláris lágyrész szarkómában. Mit tudunk? Eur J Cancer 2003; 39: 1511-6.
31. Ogose A, Yazawa Y, Ueda T, et al. Alveoláris lágyrész szarkóma Japánban: a japán izomrendszeri onkológiai csoport 57 betegének több intézményes vizsgálata. Oncology 2003; 65: 7-13.
32. Lazar AJ, Lahat G, Myers SE, és mtsai. A potenciális terápiás célpontok validálása alveoláris lágyrész szarkóma esetén: immunhisztokémiai vizsgálat, amely szöveti mikroarray-t használ. Histopathology 2009; 55: 750-5.
33. Tsuda M, Davis IJ, Argani P. et al. A TFE3 fúziók aktiválják a MET jelátvitelt transzkripciós felszabályozással, meghatározva a tumorok egy másik csoportját, mint a terápiás MET-gátlási jelöltet. Cancer Res 2007; 67: 919-29.
34. Azizi AA, Haberler C, Czech T, et al. Vaszkuláris endoteliális növekedési faktor (VEGF) expresszió és az angiogenesis gátló bevacizumabra adott válasz lehetséges metasztatikus alveoláris lágyrész szarkómában. Lancet Oncol 2006; 7: 521-3.
35. Vistica DT, Hollingshead M, Borgel SD, et al. Alveoláris lágyrész szarkóma (ASPS) in vivo modelljének terápiás sebezhetősége antiangiogén terápiához. J Pediatr Hematol Oncol 2009; 31: 561-70.
36. Stacchiotti S, Tamborini E., Marrari A, et al. A szunitinib-malátra adott válasz az előrehaladott alveoláris lágyrész szarkómában. Clin Cancer Res 2009; 15: 1096-104.
37. Liebl LS, Elson F, Quaas A, Gawad KA, Izbicki JR. Az ismételt reszekció értéke a lágyrészek szarkóma tüdőmetasztázisaiban való túléléshez. Anticancer Res 2007; 27: 2897-902.
38. Demetri GD, Antonia S, Benjamin RS, et al. Lágyszöveti szarkóma. J Natl Compr Canc Netw; 8: 630-74.
V7N6 ESUN Copyright © 2010 Liddy Shriver Szarkóma Kezdeményezés.
ASPS történetek és támogatás
Megosztja a történetet?
Szeretnénk kitölteni ezt az oldalt olyan túlélési történetekkel, amelyek reményt és bátorítást nyújtanak mindenkinek, aki az alveoláris lágyrész szarkómáról tanul. Kérjük, fontolja meg a történet megosztását.
Csatlakozzon az ASPS betegekhez és családjaikhoz

Az iCureASPS Fórum: Az iCureASPS célja, hogy összehozza az Alveolar Soft Part Sarcoma (ASPS) betegeket, családtagjaikat és barátait, akik közös érdeklődéssel rendelkeznek az ASPS gyógymód megszerzésére. Az online fórum segítségével a tagok megoszthatják egymással tapasztalataikat és információt kaphatnak az ASPS közösségtől az egész világon. A betegek kommunikációján keresztül létrehozott információs hálózat segít értékes információkat gyûjteni erről a nagyon ritka betegségrõl, és kulcsfontosságú a legjobb rendelkezésre álló kezelések, és végül a gyógyulás megtalálásának sikere szempontjából.
A Team Sarcoma Facebook Csoport: A Team Sarcoma Facebook csoport lehetőséget kínál arra, hogy üzeneteket cseréljen másokkal, akik mindenféle szarkómával foglalkoznak, beleértve az ASPS-et is.
Keresse meg a kezelést és támogassa a forrásokat
Tartjuk a szarkóma kezelő központok, helyi támogató csoportok és szervezetek támogatását, amelyek pénzügyi segítséget nyújtanak a szarkóma betegeknek és szeretteiknek.
Alveoláris sarcoma



Lágyszövet
Egyéb tumorok
Alveoláris lágyrész szarkóma
felülvizsgált: 2018. április 19., A legutóbbi nagyszabású változat 2012. november
szerzői jog: (c) 2002-2018, PathologyOutlines.com, Inc.

- A mély lágyszövet ritka daganata, amelyet jól meghatározott fészkekkel jellemeznek, amelyeket szálas stroma választ el
- 0,5 – 1,0% összes lágyrész-daganat
- Szájüreg, garat, mediastinum, comb / láb mély lágyszövet
- Általában fiatal nők
- Nagyon rosszindulatú, jóllehet a klinikai gyakorlat lassú / szívtelen
- Metasztázisok 30 évvel később vénák, tüdő, egyéb
- A tüdő metasztázisok lehetnek jellemzők
- A méret, a 17q25 rendellenesség jelenléte, az AJCC stádium, az életkor
- 5 éves fiú orbitális tumorral (Afr J Paediatr Surg 2011, 8: 82)
- 18 éves nő, primer alveoláris lágyrészekkel szájnyálkahártya és CNS metasztázisok esetén (a hét esete 222)
- 25 éves nyelvű daganat (ndian J Pathol Microbiol 2011; 54: 581I)
- 44 éves férfi metasztatikus csomókkal orrán (indiai J Dermatol Venereol Leprol 2012; 78: 666)
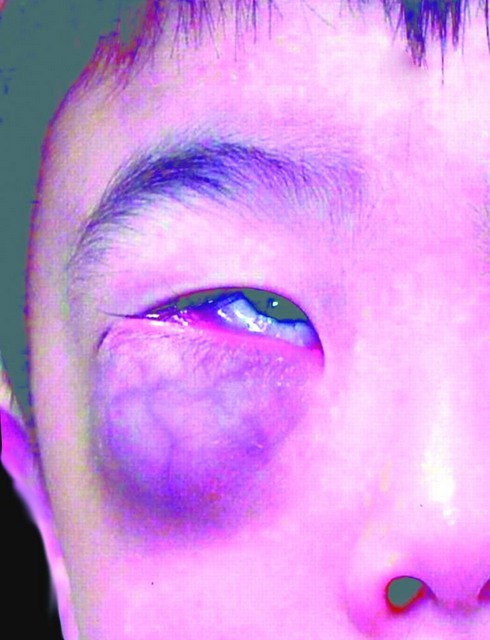
Orbital, Dr. Mark R. Wick jóvoltából

CT scan, orbitális, Dr. Mark R. Wick jóvoltából
Más kiszolgálókon tárolt képek:



- Jól körülhatárolt, nagy, szürkés – sárga, vérzés, nekrózis
- A méret 2 – 14 cm

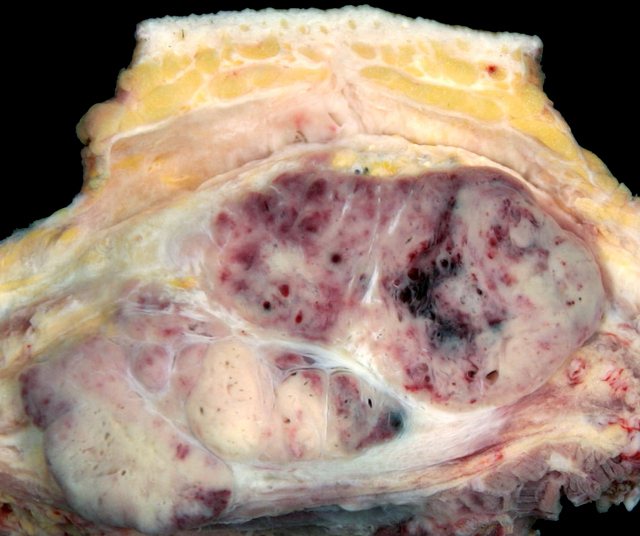
Dr. Mark R. Wick jóvoltából
Más kiszolgálókon tárolt képek:
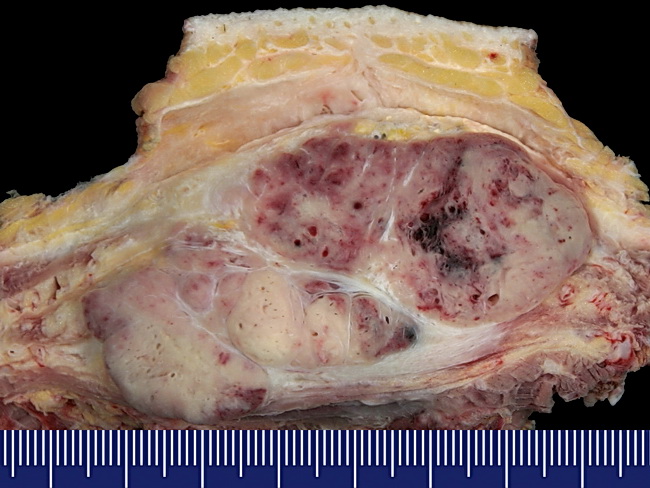
Mély lágyszövet
- A szálas sztrómával elválasztott sejtek jól meghatározott fészkei
- Alveoláris mintázat, ha a sejtek elkülönülnek
- Széles grafikonú eozinofil sejtpopulációval rendelkező nagy sokszögű sejtekből, hólyagos magokból, kiemelkedő nukleoliból
- Vaszkuláris invázió gyakori; szintén jellemző rúd alakú kristalloidok
- Nem / ritka mitotikus ábrák, minimális pleomorfizmus
A PathOut szerveren tárolt képek:
Dr. Andrey Bychkov jóvoltából:

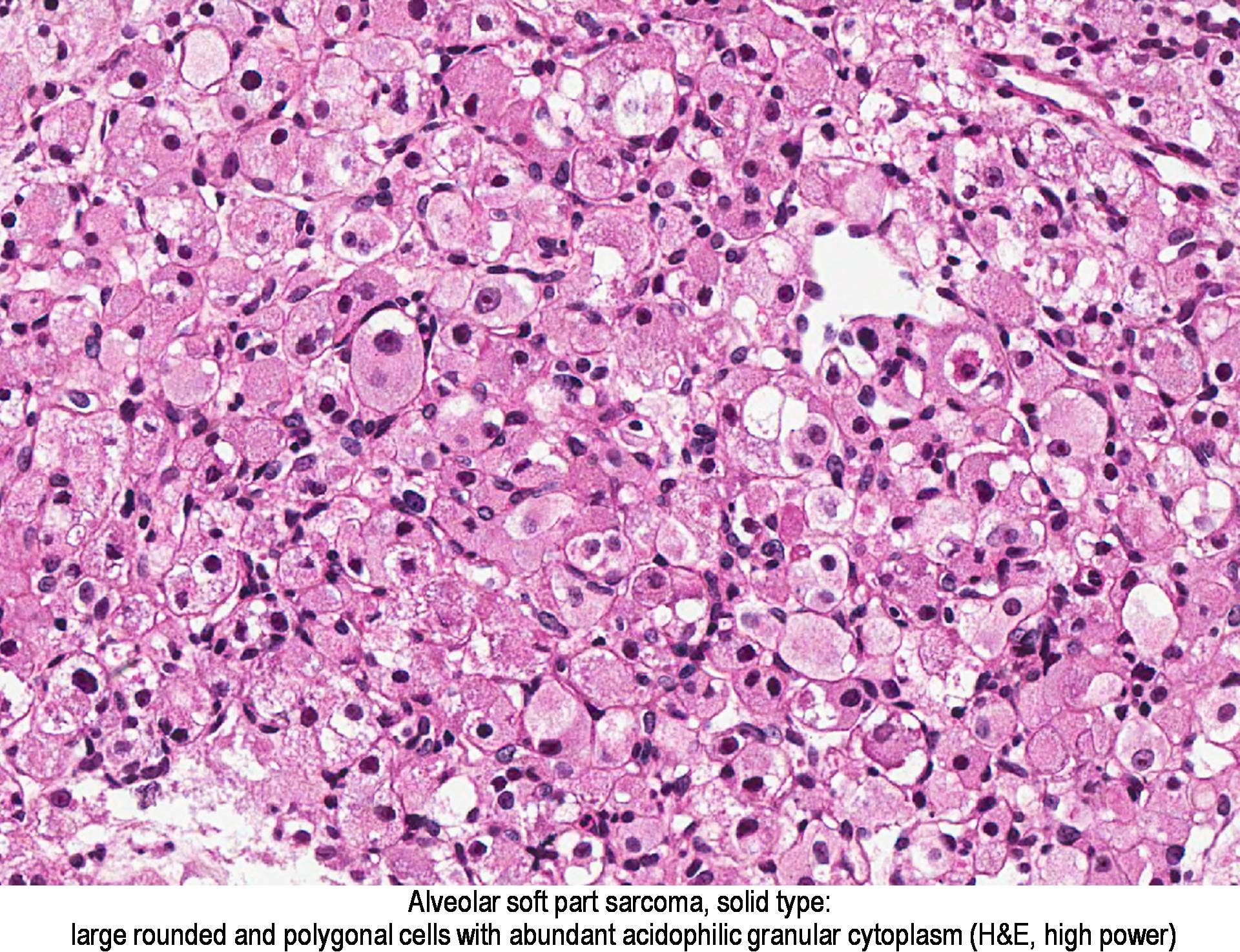
Nagy, lekerekített, sokszögű
bőséges sejtek
acidophil granuláris citoplazma
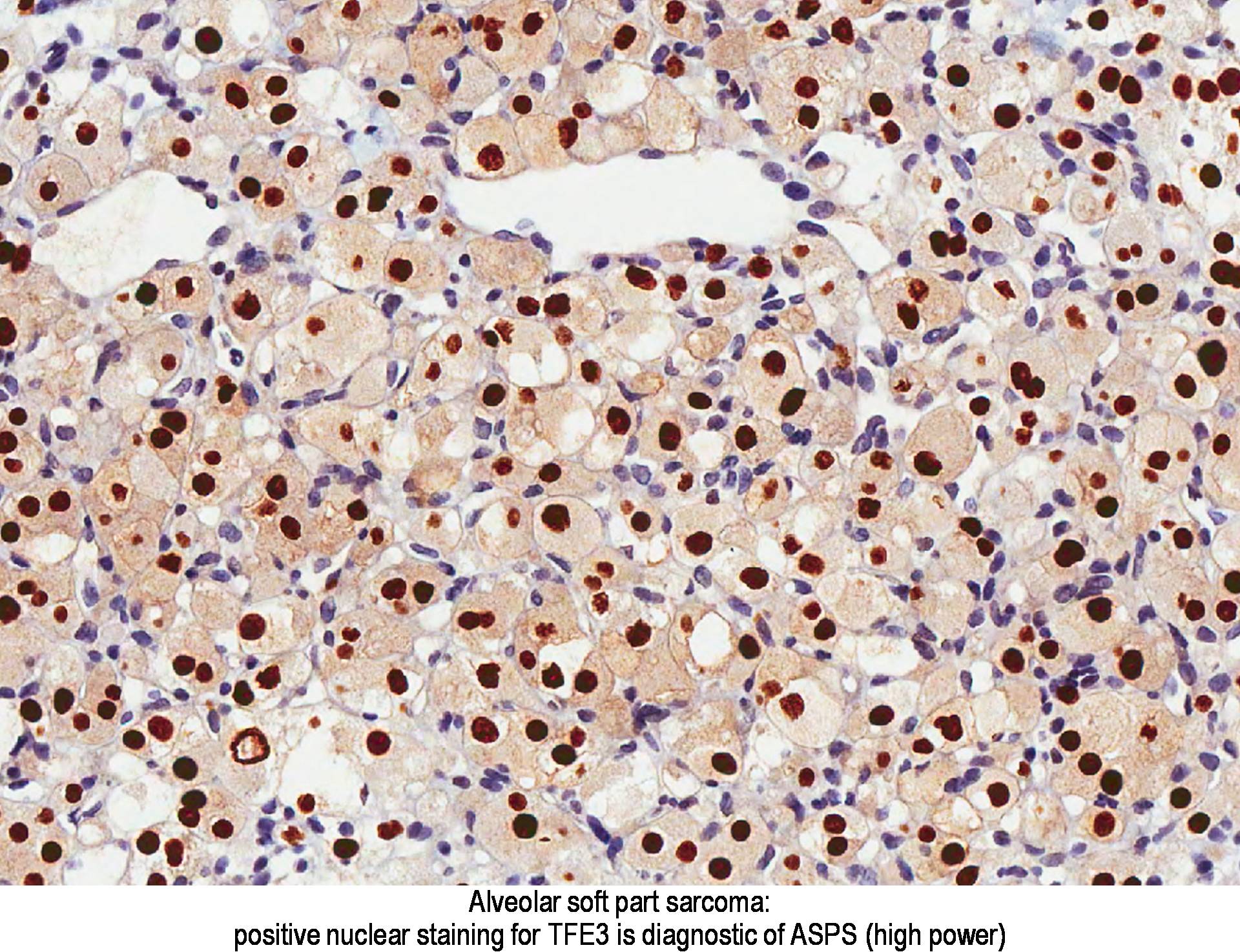
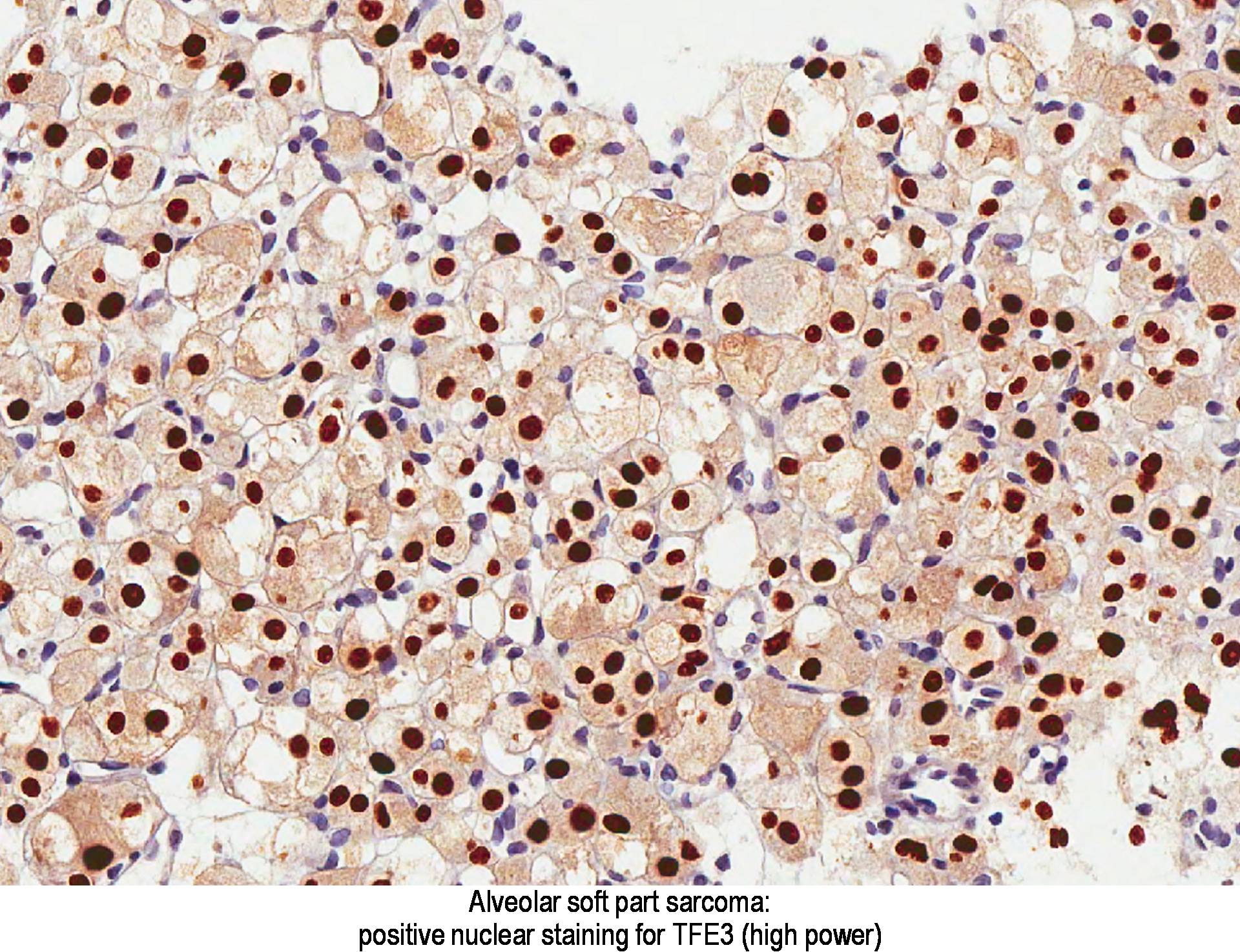
A TFE3 pozitív nukleáris festése az ASPS diagnosztikája

Kommentek
Kommenteléshez kérlek, jelentkezz be: