Diffúz nagy B-sejtes limfóma
Ez az oldal a diffúz nagy B-sejtes limfóma (DLBCL), a leggyakoribb típusú (gyorsan növekvő) nem-Hodgkin-lymphoma (NHL) leggyakoribb típusa.
Ezen az oldalon
Mi a diffúz nagy B-sejtes lymphoma (DLBCL)?
A limfóma akkor alakul ki, amikor a limfociták (a fehérvérsejtek egy típusa) kezdenek szabálytalanul felosztani. Rengeteg különböző típusú limfóma létezik. A diffúz nagy B-sejtes limfóma (DLBCL) a leggyakoribb típusú (gyorsan növekvő) nem-Hodgkin-lymphoma. A DLBCL nevét számos funkció adja:
- abnormális B-limfocitákból (B-sejtekből) fejlődik ki,
- az abnormális sejtek nagyobbak, mint a normál, egészséges B-sejtek
- az abnormális sejteket diffúz módon diffundálják (összevetve, nem csoportosítva) a tumor egészében, és törlik ki a nyirokcsomó (mirigy) normális szerkezetét.
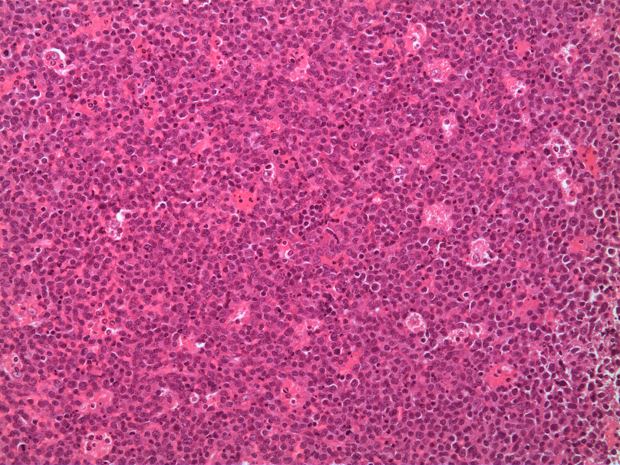 Ábra: A DLBCL biopsziás sejtjei abnormális, nagy sejtek diffúz terjedését mutatják
Ábra: A DLBCL biopsziás sejtjei abnormális, nagy sejtek diffúz terjedését mutatják
Az emberek túlnyomó többségének a leggyakoribb típusa a DLBCL, amelyet ezen az oldalon ismertetnek. Vannak, akiknek ritka típusú DLBCL van, amely a leggyakoribb típusától eltérő tulajdonságokkal rendelkezik. Ezek a különbségek mikroszkóppal és a lymphomasejteken végzett vizsgálatokban láthatók. Különböző tüneteket okozhatnak, de mindegyiket általában ugyanúgy kezelik.
Ha ritkán diagnosztizálták a DLBCL-et, érdemes elolvasnia az ezen oldal végén található szakaszokat, ahol további információ található ezekről a típusokról és az általuk okozott tünetekről. Ha DLBCL-vel diagnosztizált, és nem az alábbi ritka típusok közül, akkor érdemes kihagyni ezeket a szakaszokat.
A ritka DLBCL típusok a következők:
Nagyon ritka nagy méretű B-sejtes limfóma alakulhat ki súlyos immunrendszeri problémákkal küzdő emberekben, mint például a humán immunhiányos vírus (HIV), pl. Plazmablasztus lymphoma.
Ha a központi idegrendszerben (CNS, agy, gerincvelő és szem) a DLBCL kezdődik, akkor ez egy elsődleges központi idegrendszeri lymphoma.
A DLBCL egyes típusai csak a bőrre hatnak. Külön információ van a bőr lymphomájáról.
Ki kap DLBCL-et és miért?
Körülbelül 4.800 embert diagnosztizálnak DLBCL-rel minden évben az Egyesült Királyságban. Bármilyen életkorban fordulhat elő, beleértve a gyermekeket is, de a DLBCL kialakulásának kockázata az életkorral növekszik. A DLBCL diagnosztizált betegek többsége 65 éves vagy idősebb. A DLBCL kissé több embert érint, mint a nők.
A legtöbb esetben a DLBCL okai nem ismertek. Ritkán van összefüggés a DLBCL és az immunrendszer zavarai között. Ezek tartalmazzák:
- autoimmun rendellenességek, például reumatoid arthritis és szisztémás lupus erythematosus (a DLBCL krónikus (hosszú távú) gyulladás következményeként alakulhat ki)
- HIV
- szervátültetés.
Azonban a legtöbb ilyen betegségben szenvedő beteg soha nem alakul ki limfóma, és a DLBCL legtöbb esete nem kapcsolódik az alapbetegséghez.
Néha a DLBCL olyan betegeknél alakul ki, akiknek a múltban alacsonyfokú (lassan növekvő) limfóma volt – a lymphoma átalakul (változások) egy gyorsabban növekvő DLBCL-be. Ha ez a helyzet az Ön számára, az átalakításra vonatkozó információink is hasznosak lehetnek.
A legtöbb DLBCL-ben szenvedő ember először észrevesz fájdalmatlan csomókat, gyakran a nyakukban, a hónaljban vagy az ágyékban. Ezek nagyított nyirokcsomók (duzzadt mirigyek). Gyorsan nőhetnek, csak néhány hét alatt.
A DLBCL a nyirokcsomókban a test mélyén alakulhat ki, ahol kívülről nem érezhető. Nagyon gyakori a DLBCL-nek szenvedő betegeknél, hogy limfóma extranodális helyeken (a nyirokcsomóponton kívül eső területeken) van. Nagy méretű csomók keletkezhetnek – ez “terjedelmes betegségnek” hívják.
A DLBCL-t nehéz diagnosztizálni, mivel az emberek különböző tüneteket mutatnak, attól függően, hogy milyen szervek és szövetek milyenek a lymphoma, például:
- A DLBCL a gyomorban vagy a bélben hasnyálmirigy-érzést okozhat, fájdalmat, hasmenést vagy vérzést okozhat
- A mellkasi DLBCL köhögést vagy légszomjat okozhat.
Néhány ember, akiknek a DLBCL-je tapasztalatai vannak, éjszakai izzadás és megmagyarázhatatlan fogyás. Ezeket “B-tüneteknek” nevezik.
A fáradtság és az étvágycsökkenés is meglehetősen gyakori, és egyesek súlyos viszketést tapasztalnak.
Diagnózis és beavatkozás
A DLBCL-t rendszerint egy biopsziával diagnosztizálják (szövetmintát veszünk, ha lymphoma sejtek vannak jelen).
További vizsgálatokat lehet tenni annak érdekében, hogy orvosodat tájékoztassuk a limfómáról. Például a DLBCL több altípusát lehet észlelni:
- B-sejt-szerű vagy GCB altípusú germinális központ
- nem GCB típusú, általában aktivált B-sejtszerű (ABC altípus).
Jelenleg a DLBCL legtöbb emberének ugyanolyan bánásmódban részesülnek. A kutatók azonban továbbra is lekicsinyelik a limfómasejtek biológiáját annak érdekében, hogy azonosítsák az embereket, akik nagyobb valószínűséggel reagálnak bizonyos kezelésekre. Rendszeres frissítéseink vannak a klinikai vizsgálatokban és a lymphoma kutatások előrehaladtával a mi hírcsoportunkban és a magazinunkban, A limfóma fontos.
A kezelőorvos a “kettős hit lymphoma” kifejezést használhatja, ha a limfómasejtek 2 fő lymphomával kapcsolatos változása van a génjeiben. A kettős hatású DLBCL-nek intenzívebb kezelésre van szüksége.
Egyéb tesztjei vannak:
- hogy melyik testrésze van a lymphomának
- nézze meg általános egészségi állapotát, beleértve azt is, hogy milyen jól működnek a szív és a vese szervei.
Ezt nevezik “beállónak”. Az 1. és a 2. lépés a “korai stádium” DLBCL. A “fejlett szakasz” DLBCL a 3. és a 4. szakasz. A legtöbb embernek diagnosztizált állapotban van a fejlett DLBCL.
Ezek a vizsgálatok általában vérvizsgálatokat és vizsgálatokat tartalmaznak, mint például a CT vagy PET / CT vizsgálatok. Lehet, hogy csontvelő-tesztje is van annak megállapítására, hogy van-e lymphoma sejtje a csontvelőben.
Várakozás a teszt eredményére aggasztó idő, de nagyon fontos, hogy a diagnózis helyes, hogy Önnek a legjobb kezelést.
Olvassa el Colin személyes tapasztalatait, ahol arról beszél, hogy diagnosztizáltak a DLBCL-lel.
A DLBCL-t bármelyik stádiumban általában kezeljük azzal a céllal, hogy meggyógyítsuk. A kilátások a lymphoma és általános egészségi állapotától függenek. A kutatók kezdik feloldani a különbségeket a DLBCL különböző altípusai között. Ez segít nekik azonosítani azokat a személyeket, akiknél a legvalószínűbb, hogy bizonyos kezelésekből részesülnek.
Orvosa a legjobb helyzetben van ahhoz, hogy az Ön egyedi körülményei alapján tanácsot adjon a kilátásokról. Használhatják tesztjeinek eredményeit, és megfontolhatják más egyéni tényezők – például az életkor és a tünetek – előre megmondani, hogy milyen valószínűséggel reagál az adott kezelésre. Ezeket a tényezőket “kockázati tényezőknek” hívják.
Orvosa prognosztikai pontszámot számolhat az International Prognostic Index (IPI) alkalmazásával, amely figyelembe veszi a különböző kockázati tényezőket. Az Ön IPI-jével vagy kockázati tényezőivel kapcsolatos pontszámát a kezelés megtervezéséhez használják.
A magas fokú lymphomák gyakran reagálnak a kezelésre, és sokan remisszióba mennek (nincs bizonyíték a limfómára). Általánosságban elmondható, hogy a korai stádiumú DLBCL-ből több ember jut el remisszióba, mint az előrehaladott stádiumú DLBCL betegeknél.
A túlélési statisztikák zavaróak lehetnek, mivel nem mondják meg, hogy mi az Ön személyes kilátása – csak azt mondják el, hogy egy adott csoport egy időben ugyanazt a diagnózist végezte el. Ne felejtsük el, hogy a kezelések folyamatosan javulnak, és a túlélési statisztikákat általában 5 vagy 10 évvel a kezelés után mérik. Vegye figyelembe azt is, hogy ezek a statisztikák csak azt mutatják be, hogy az emberek hogyan történtek a múltban. Ezek az emberek különböző kezelést kaptak a tiédtől. E változékonyság miatt sokan nem találják a túlélési statisztikákat.
Ha többet szeretne tudni a DLBCL túlélési statisztikáiról, akkor a Cancer Research UK néhány olyan információt tartalmaz, amelyek hasznosak lehetnek.
Amikor orvosi csapata tervezi, hogyan kezelje Önt legjobban, több tényezőt is figyelembe vesz, többek között:
- a limfóma szakaszában
- a limfómáról a biopsziáról és a vérvizsgálati eredményekről
- ahol a testedben a lymphoma fejlődött, és milyen szövetek és szervek hatással vannak
- az általános egészségi állapotát.
Egyes kórházak részmunkaidős vizsgálatokat végeznek a kezelésen keresztül, hogy megtudják, hogyan reagál.
Ha Ön 18 évesnél fiatalabb, vagy 18 évesnél fiatalabb szülő vagy gondozója, aki DLBCL-nel rendelkezik, a nem-Hodgkin-limfómában szenvedő gyermekekről szóló részünk több információt tartalmaz a kezelésről ebben a korcsoportban. A DLBCL-lel rendelkező fiatalok (legfeljebb 24-ig) hasznosnak találhatják a fiatalok lymphomájára vonatkozó részünket.
Az orvosi csoportnak tájékoztatást kell nyújtania az általuk javasolt kezelés lehetséges mellékhatásairól és késői hatásairól (mellékhatások, amelyek hosszabb kezelést követően).
A korai stádiumú DLBCL kezelése
A korai stádiumú DLBCL (1. vagy 2. stádiumú) betegek többségét rövid kemoterápiás vagy kemo-immunterápiával kezelik (az antitestterápiában adott kemoterápiát), amelyet radioterápia követ.
A leggyakrabban alkalmazott kemoterápiás kezelés (gyógyszerek kombinációja) a CHOP, amely magában foglalja:
- 3 kemoterápiás gyógyszerek: ciklofoszfamid, hidroxi-aunorubicin (doxorubicin) és vinkrisztin (Oncovin®)
- prednizolon (szteroid).
A kemoterápiához általában a ritualimot adják. A rituximab egy antitestterápia. Ez a kemo-immunterápiás kezelés R-CHOP néven ismert.
A gyógyszereket ciklusokban adják meg, bizonyos napokon adott kezeléssel, majd egy pihenőidővel, amelyet a szervezet a következő ciklus előtt visszakaphat. Minden ciklus általában 3 hétig tart. A korai stádiumú DLBCL legtöbb emberének 2-4 ciklusa CHOP vagy R-CHOP van. Ha nagyon nagy nyirokcsomói vannak (terjedelmes betegség), orvosa javasolhatja, hogy 4-6 ciklus kemoterápiát kapjon sugárterápia előtt.
A legtöbb gyógyszere van intravénásan (vénába). A prednizolont tabletta formájában adják be. A legtöbb ember kórházba kerül, hogy kezelje őket, és nem kell egy éjszakára maradnia.
Lehet, hogy sugárterápia van a lymphoma által érintett területre a kemo-immunterápia folyamán. Nagyon ritkán a radioterápiát önmagában alkalmazzák, ha nem eléggé elegendő kemoterápiára, pl. Ha súlyos szív- vagy tüdőbetegsége van.
Ha DLBCL-vel rendelkezik olyan területen, ahol nehezen kezelhető a sugárkezeléssel, hosszabb ideig tarthat a kemoterápia során.
A fejlett DLBCL kezelése
A fejlett DLBCL (3. és 4. szakasz) rendszerint hosszabb R-CHOP folyamattal kezeljük. Összesen 6-8 ciklusú kezelést kapunk.
Ha a limfóma olyan jellemzőkkel rendelkezik, amelyek azt sugallják, hogy nehezen kezelhetők, pl. Kettős hit lymphoma, orvosa javasolhat intenzívebb kemo-immunterápiás kezeléseket, mint például:
- R-CODOX-M / R-IVAC – amely rituximabot, ciklofoszfamidot, doxorubicint, vinkrisztint, metotrexátot, etopozidot, ifoszfamidot és cytarabinot tartalmaz.
- DA-EPOCH-R – amely dózissal beállított etopozidot, prednizolont, vinkrisztint, ciklofoszfamidot és doxorubicint tartalmaz.
Egyesek nem elégségesek ahhoz, hogy erős kemoterápiát kapjanak. Másoknak egészségügyi problémái vannak, például szívproblémák, ami azt jelenti, hogy a CHOP nem alkalmas rájuk. Ezekben az esetekben eltérő rendszert alkalmaznak, pl.
- R-miniCHOP – amelyben az egyes gyógyszerek adagja csökken, vagy a gyógyszerek egy része elhagyható
- R-GCVP – amely a doxorubicin helyett gemcitabint alkalmaz
- R-CEOP – amely a doxorubicin helyett etopozidot használ.
A legtöbb előrehaladott stádiumú DLBCL-ben szenvedő emberek nem rendelkeznek radioterápiával, mivel a limfómák elterjedtek, és nem lokalizáltak 1 vagy néhány területen. Azonban lehet, hogy sugárterápiája van, ha:
- akkor a kemoterápia után maradt lokalizált limfóma van
- nagy terjedelmű betegsége van – a radioterápia segíthet megakadályozni a lymphoma visszaesését (visszatérő) ezen a területen.
Orvosa javasolhat egy újabb célzott gyógyszert. Ezek rendszerint csak klinikai vizsgálaton keresztül érhetők el.
CNS profilaxis a DLBCL-ben
Körülbelül 20-nál 1 embernek van DLBCL, amely a központi idegrendszerben (központi idegrendszer, az agy és a gerincvelő) magába foglalja a remisszió után. Ha ez megtörténik, a limfóma nagyon nehéz kezelni.
Ha úgy ítélik meg, hogy nagy a kockázata annak, hogy a központi idegrendszeri lymphoma visszaesik, megelőző kezelést kaphat – “CNS prophylaxis”. A legtöbb kemoterápia nem képes eljutni az agyadra vagy a gerincvelődre, így a fennmaradó lymphoma sejtek növekedhetnek és a központi idegrendszeri lymphomát okozhatják.
A központi idegrendszeri prophylaxisban olyan gyógyszereket kapnak, amelyek eljutnak a központi idegrendszerbe. Lehet, hogy intrathecális kemoterápiával rendelkezik, ahol a kábítószer, mint a metotrexát, az ágyéki lyukasztás közvetlenül a gerincet körülvevő folyadékba kerül. Néhány ember intravénásan alkalmazza a központi idegrendszeri profilaxist. A központi idegrendszeri profilaxis a kemo-immunterápia során vagy a kemo-immunterápia befejezése után adható meg.
Relapsed és refractory DLBCL
Valószínűleg átvizsgálja a kezelés végét, hogy megtudja, milyen jól reagált. Sokan jól reagálnak a DLBCL első kezelésére, és teljes remisszióra mennek. Néhány embernek azonban több kezelésre van szüksége, például:
- a limfóma csökkenthető, de nem teljesen tisztázott
- a lymphoma lehet a refrakter a kezelés (nem jött jobb).
Néha a lymphoma visszaesik (visszatér) a sikeres kezelés után. A relapszus valószínűleg az első kezelés végétől számított 2 éven belül megtörténik. Az idő múlásával a limfóma valószínűleg visszaesik.
A legtöbb ember, akinek relapszusos vagy refrakter lymphoma van, más kezeléseket is kínál. Ezt néha “rescue” kezelésnek nevezik.
Ha elég jól vagy, orvosa javasolhatja, hogy magas dózisú kemo-immunterápiát kapjon. Az ilyen típusú kezelés célja a limfóma csökkentése, majd az őssejt-transzplantációval növelni a remissziót. Az őssejt-transzplantáció akkor működik hatékonyan, ha a limfóma legalább részben a nagy dózisú terápiára reagál.
A legtöbb ember őssejt-transzplantációt használ saját sejtjeivel (autológ). Egyes esetekben donor őssejt-transzplantációt (allogén) adhatunk. Például, ha egy autológ őssejt-transzplantáció után visszatér, vagy az orvosok képtelenek gyűjteni elég saját őssejtjeiket.
Számos különböző kemo-immunterápiás rendszert alkalmaznak azokra az emberekre, akiknek intenzívebb (erős) kezelésre van szükségük. A legtöbb ember egy platina-alapú rendszert kap, például:
- R-GDP – rituximab gemcitabinnal, dexametazonnal és ciszplatinnal
- R-DHAP – rituximab a dexametazonnal, citarabinnal és ciszplatinnal
- R-ICE – rituximab és ifoszfamid, karboplatin és etopozid.
Ha nem elégséges az őssejt-transzplantációhoz, még mindig képes lesz kemo-immunterápiára.
A DLBCL számára is sok célzott gyógyszer van fejlesztés alatt. Orvosa javasolhatja, hogy vegyen részt egy klinikai vizsgálatban, hogy hozzáférést biztosítson egy újabb gyógyszerhez.
Kutatás és célzott kezelések
A DLBCL-ben tesztelt, de az Egyesült Királyságban még nem engedélyezett gyógyszerek a következők:
- olyan gyógyszereket, amelyek blokkolják a jeleket vagy a kontrollfehérjék funkcióit a limfómasejteken belül, amelyek attól függően, hogy működnek, csoportosíthatók:
- sejtjel blokkolók, pl. ibrutinib (Imbruvica ®)
- proteaszóma inhibitorok, például bortezomib (Velcade ®)
- újabb CD20 elleni ellenanyagok, a rituximab által célzott fehérje, pl. obinutuzumab (Gazyva ®)
- antitest-hatóanyag konjugátumokat, amelyek egy erős rákellenes hatóanyagot csatlakoznak egy ellenanyaghoz, hogy a hatóanyagot közvetlenül a rákos sejtekhez juttassák, például a brentuximabvetotint (Adcetris®), az inotuzumab ozogamicint és a polatuzumabvetotint
- immunmoduláló szerek, amelyek befolyásolják az immunrendszer működését, pl. lenalidomid (Revlimid ®)
- immun-ellenőrzőpont-inhibitorok, amelyek lehetővé teszik az immunrendszer felismerését és megölését a limfómasejtek, pl. a nivolumab és a pembrolizumab
- újabb kemoterápiás gyógyszerek, pl. pixantrone (Pixurvi®).
Csak a tesztelés későbbi szakaszaiban szerepeltek a kábítószerek. Vannak más gyógyszerek a korai fázisban végzett klinikai vizsgálatokban, és új gyógyszereket fejlesztenek és tesztelnek folyamatosan.
Egy másik növekvő kutatási terület a CAR T-sejtes terápia. Ez magában foglalja a saját immunsejtjeinek felkészítését arra, hogy felismerjék és megtámadják a limfómasejteket. Nagyon érdekel ez a terület, de a kísérletek még mindig a korai szakaszban vannak.
Tudjon meg többet a klinikai vizsgálatokról, és keressen olyan vizsgálatot, amely alkalmas lehet a Lymphoma TrialsLink-re.
A kezelés végén ellenőrizzük, hogyan reagáltunk. Ez általában PET / CT. Néha nehéz eldönteni, hogy a testben a csomók a kezelés után hegek vagy lymphomák. A PET / CT-vizsgálat az aktív (növekvő) limfóma területét mutatja.
Lehet, hogy más vizsgálatokra is szüksége lehet a kezelés befejezése után. Orvosa szükség esetén alkalmazhatja a szkennelés eredményeit és egyéb vizsgálatokat, ha látja, hogy Ön remisszió-e (nincs-e lymphoma-bizonyíték) vagy ha további kezelésre van szüksége.
Ha a kezelés után remisszió van, rendszeres utógondozói vannak. Ezek a következők:
- jól kezeli a kezelést
- nincs visszaesés jele
- nem okoz késői hatásokat (mellékhatások, amelyek a kezelést követő hónapokban vagy években alakulnak ki).
Minden egyes időpontban az orvosa megvizsgálja Önt, és megkérdezi, vannak-e aggályai vagy tünetei. Lehet, hogy vérvizsgálata van. Nem valószínű, hogy átvizsgálja, hacsak nem tünetei vannak.
Valószínűleg először 3 havonta látni fogják. Egy év múlva, a kinevezésed lehet minden 6 hónap. A DLBCL relapszációjának kockázata az első 2 évben legmagasabb. Az idő múlásával a relapsus kevésbé valószínű, és ritkábban látsz. A kórházak különböznek abban, hogy mennyi ideig követték nyomon. A nyomon követés időtartama függ az Ön egyéni körülményeitől, pl. Milyen típusú DLBCL-t kapott és milyen kezelést kapott. Az embereket általában a DLBCL kezelés után 2-5 évig követik.
Az élet a lymphoma után: Blair története
A DLBCL ritka típusai
Néhány ritka DLBCL típus létezik:
Ezek a limfómák különböző tüneteket okoznak a közös DLBCL típusnál, de az alkalmazott tesztek és kezelések általában ugyanazok.
Ha nem rendelkezik ilyen ritka DLBCL típusokkal, érdemes kihagynia ezt a szakaszt.
T-sejt / hisztokiocta gazdag nagy B-sejtes lymphoma
A T-sejt / histiocyte-gazdag nagy B-sejtes lymphoma elsősorban a középkorú férfiakat érinti, de bármilyen korú férfiakat és nőket érinthet.
A biopsziájában a B sejtek kis része a T-sejtekkel együtt, és gyakran a histiociták (más típusú immunsejtek). A T-sejt / histiocyte-gazdag nagy B-sejtes lymphoma mikroszkóp alatt nézhet ki Hodgkin-limfóma formájában. Fontos, hogy pontosan diagnosztizálják, így a leghatékonyabb kezelést élvezheti.
A leggyakoribb tünetek a következők:
- duzzadt nyirokcsomók (mirigyek)
- a máj vagy a lép duzzanata, ami hasi (hasi) duzzanatot és kellemetlenségeket okozhat
- általában rosszul érzi magát, B-tünetekkel (láz, éjszakai izzadás és megmagyarázhatatlan fogyás).
Az idősek EBV-pozitív DLBCL-je
Ez a fajta lymphoma az 50 év felettieknél alakul ki, átlagos korukban a 70-es évek közepétől. Ez valamivel gyakoribb a férfiaknál.
Úgy gondolják, hogy ez a limfóma kialakul, amikor az Epstein-Barr vírus (EBV) beavatkozik a szervezet immunrendszerébe. Ezt a limfómet néha “korral összefüggő EBV-hez társuló B-sejtes limfoproliferatív rendellenességnek” hívják.
A világon sok ember fertőzött az EBV-vel, és a fertőzés általában nem okoz tüneteket. Nem ismert, hogy egyes EBV-betegek milyen lymphomában szenvednek.
Tünetei attól függenek, hogy a lymphoma növekszik-e:
- A legtöbb ember (7-ből 10-nél) lymphoma van extranodálisan (a nyirokcsomókon kívül), leggyakrabban a bőr, a tüdő, a mandulák vagy a gyomor.
- Néhány ember (3-ból 10-ből) csak a nyirokcsomókban található ez a limfóma.
Primer mediastinális (thymicus) nagy B-sejtes lymphoma (PMBL)
Az elsődleges mediastinalis nagy B-sejtes limfóma általában a fiatal felnőtteket érinti. A limfóma kialakulásának átlagos életkora 35 év. A nőknél gyakoribb.
A limfóma a mediastinumban kezdődik, amely a mellkas közepén, a szegycsont mögött (a mellbimbó) múlik. Gyakran nagy a nyirokcsomó (terjedelmes betegség). A nyirokcsomókra terjedhet.
A PMBL okozhat problémákat a tüdő, a nyelőcső vagy a felső vena cava megnyomásával (a nagy véna, amely vért visz vissza a testből a szívbe). Ez vezethet a szív körüli folyadékgyűjteményhez (perikardiális folyadékgyülem) vagy a tüdőbe (pleurális folyadékgyülem). Lehetséges korai tünetek:
- légszomj
- köhögés
- nyelési nehézség
- a nyak és az arc duzzanata
- fejfájás
- szédülés.
Orvosa javasolhat intenzívebb kemoterápiás kezelést az adott típusú limfóma számára, például dózissal korrigált EPOCH-ot. Orvosa többet tud adni Önnek a megközelítés kockázatairól és előnyeiről.
Intravaszkuláris nagy B-sejtes limfóma
Ez a limfóma főként az idősebb felnőttkorban fordul elő – az átlagos 60-as évek közepén. Hasonló számú férfi és nő érintett. A rákos limfociták a “kapillárisok” nevű kis vérerekben találhatók.
A tünetei attól függnek, hogy melyik kapillárisok érintettek. Lehetséges tünetek a következők:
- idegrendszeri tünetek, például zavartság, görcsrohamok, szédülés vagy gyengeség
- vörösesített foltok vagy csomók a bőrön
- B-tünetek (láz, éjszakai izzadás, megmagyarázhatatlan fogyás).
Ha a limfóma csak a bőrére hat, akkor kizárólag radioterápiával kezelheti.
ALK-pozitív nagy B-sejtes lymphoma
Ez a nagyon ritka típusú DLBCL minden korosztályból érkező embereket érinti. Főként a férfiaknál fordul elő. A limfómasejtek olyan mutációval rendelkeznek, amely felszínükön expresszál egy “anaplasztikus nagysejt-kináz (ALK)” nevű fehérjét. Általában nincs CD20 a felületükön, így a rituximab nem működik az ilyen típusú limfóma esetén.
A legtöbb emberben nyirokcsomók vannak (duzzadt mirigyek), de a lymphoma a mediastinumban (a mellkas közepén) vagy az extranodális helyeken (a nyirokcsomókon kívül) nő.
Irodalom
Az információk elkészítéséhez használt források teljes listája kérésre hozzáférhető. Vegye fel velünk a kapcsolatot e-mailben publications@lymphoma-action.org.uk vagy telefonon 01296 619409 ha egy másolatot szeretne.
Swerdlow SH és munkatársai (szerkesztők). A hemopoetikus és limfoid szövetek tumorainak WHO szerinti osztályozása. 4. kiadás. 2008. Nemzetközi Rákkutató Ügynökség (IARC), Lyon, Franciaország.
Diffúz nagy B-sejtes limfóma
A diffúz nagy B-sejtes limfóma, a láb típusa (DLBCL) a bőr B-sejtes limfóma (CBL) agresszív altípusa, és a szövettani jellemzők alapján megkülönböztethető a többi primer bőrsejtes limfóma típusától. nagyméretű limfociták kerek sejtmorfológiával.
Kapcsolódó kifejezések:
Tudjon meg többet a diffúz nagy B-sejtes lymphomáról
Hematopoietic rákok
Tak W. Mak, Mary E. Saunders, The Immune Response, 2006
Diffúz nagysejtes limfóma (DLCL).
A DLCL a leggyakoribb NHL altípus a felnőttek körében, amely e rákok 33% -át teszi ki (a gyermekkori NHL-k 12% -a). A DLCL-ben szenvedő betegek általában a gyorsan terjedő nyirokcsomókkal, valamint a gasztrointesztinális traktusban, a csontokban és / vagy a központi idegrendszerben található extra noduláris növekedésekkel rendelkeznek. A DLCL a diffúz növekedési mintázatából és a daganatsejtek nagyméretéből származott. Morfológiai szempontból a DLCL tumorsejtek leginkább a centícitákhoz hasonlítanak, bár központiblasztszerű sejtek is jelen lehetnek. A szomatikus hypermutations általában megtalálható az Ig génekben, hogy a DLCL-t GC-ként kezeljék. A DLCL tumorsejtek általában pozitívak a CD19, CD20, CD22 és CD79a B-sejtmarkerek esetében, de negatívak a CD23, CD43 és TdT esetében. A sejtek egyes tumorokban CD5 vagy CD10-et expresszálnak.
A DLCL számos morfológiai változata létezik, többek között centroblastic DLCL (amelyben a tumorsejtek a központi blasztokat leginkább hasonlítják); immunoblasztos DLCL (amelyben a tumorsejtek nagy, gyorsan proliferáló limfociták nagy magokkal, klumpáit kromatin, különálló nukleolok és bazofil citoplazmák); és anaplasticus DLCL (amelyben a tumorsejtek viselkednek, mint differenciálatlan őssejtek, és egymásra helyezkednek). Más DLCL variánsok úgy tűnik, hogy T-sejtek, hisztiociták vagy granulociták keverednek a rákos B-sejtekkel. mediastinalis A DLCL a ritka B-sejtek transzformációjából származik, amelyek a tymosás medulla-ban találhatók. Mint a neve is jelzi, éren A DLCL-t a transzformált B-sejtek adhéziója jellemzi a kapillárisok és a poszt-kapilláris vénák lumenális falain. Ezek a B-sejtek elszaporodhatnak ezen edényeken belül, és felhalmozódhatnak oly módon, hogy az edények tágulnak. A DLCL két extranodális variánsa CNS lymphoma és herének lymphoma. A központi idegrendszeri lymphoma tumorai nagyon agresszívak és gyorsan beszivárognak az agyban, a meningésben és a szemekben. Ez az NHL nehéz kezelni, mert a besugárzás és a kemoterápia kombinációja a tumorsejtekkel szemben szintén neurotoxikus. A testicularis lymphoma ritka és a 60 év feletti férfiakat érinti. Ennek az egyébként lokalizált daganatnak a nemkívánatos szövődménye a szokásos kemoterápiás / sugárterápiás rendszabályok szerint a CNS-be történő visszaesés hajlamát jelenti. Így, ahogy az ALL és B-LBL kezelés esetében is igaz, megelőző intratekális kemoterápiát alkalmaznak.
A DLCL-vel kapcsolatos genetikai rendellenességek közé tartoznak a kromoszomális átrendeződések vagy mutációk, amelyek aktiválják a Bcl-6 gént a 3q26-ban. A Bcl-6 gént “promiscuous translocator” -ként ismerték, és a Bcl-6 transzlokációját egy tucat különböző kromoszomális helyre találták a DLCL tumorsejtekben. A leggyakoribb partnerek a 14q32-es Igh lokusz és a 22q11 MN1 gén. Más DLCL esetekben a Bcl-6 deregulációjához vezető promóter metilázok vagy géncsonkok figyelhetők meg. A Bcl-2 vagy c-myc gének aktiválásához vezető transzlokációk szintén DLCL-hez vezethetnek. Ezekben az esetekben a prognózis rosszabb, mint a Bcl-6 aktivációból származó betegség esetében. Néhány DLCL tumorsejtben mutációk találhatók a p53-ban és kevésbé kedvező kimenetelűek.
Az I. és II. Stádiumú DLCL-es betegek viszonylag jól reagálnak a hagyományos CHOP kemoterápiára, az érintett szövet lokalizált besugárzásával vagy anélkül. Azonban a III. És IV. Stádiumú betegeknél erősebb agresszív kemoterápia szükséges. Egy általánosan alkalmazott gyógyszeres kezelés ciklofoszfamid, etopozid, antraciklinok, metotrexát és vinkrisztin kombinációját tartalmazza. A betegek többségén klinikai választ adnak erre a kezelési módra (és más hasonló gyógyszer-kombinációkra). Ezeknek a betegeknek hosszú távú követésére van szükség, mert a relapszusok a kezelés befejezése után sok évvel fordulhatnak elő. Ha a kemoterápia sikertelen, számos lehetőség marad. Néhány DLCL-es beteg hosszú távú válaszokat mutat az IFNα-kezelésre, és a betegek körülbelül 40% -a (általában a kis daganatok esetében) bizonyos mértékben részesül az anti-CD20-kezeléstől. Végül az autológ HCT bizonyos DLCL esetekben hatékony lehet.
Protein Engineering for Therapeutics, A. rész
Mi-Ae Lyu,. Michael G. Rosenblum, Methods in Enzymology, 2012
Fordítási relevancia
A DLBCL egy B-sejtes NHL gyógyíthatatlan, agresszív histotípusú, amely mind a magas relapszusú, mind a viszonylag rövid túléléshez társul. A DLBCL terápiás kihívás, és lehetőséget nyújt új, célzott hatóanyagok alkalmazására. Mivel a DLBCL túlzott mértékben expresszálja a BLyS receptorokat, és konstitutívan aktív NF-kB és STAT3 jelenik meg, az ilyen utakat célzó szerek terápiás jelentőséggel bírhatnak ebben a betegségben. Az rGel toxinból és BLyS-ből álló rGel / BLyS fúziós toxint értékeltük annak a képességét illetően, hogy gátolja a DLBCL növekedését. Az rGel / BLyS-kezelés következtében a foszfo-IκB-α, NF-kB DNS-kötő aktivitás, IL-6R, foszfo-STAT3, STAT3-DNS-kötő aktivitás, IL-6-indukálható STAT3 riportergén aktivitás, NF- célok és STAT3 célok, például a Bcl-xL, X-IAP, Mcl-1, survivin, c-Myc és p21. Az rGel / BLyS beadása jelentősen gátolja a tumor növekedését egy DLBCL xenograft modellben és 111 In-jelzett rGel / BLyS képes megcélozni a BLyS receptorokat expresszáló rosszindulatú B-sejt tumorokat in vivo. Eredményeink azt mutatják, hogy az rGel / BLyS potenciális terápiás hatással bír az agresszív DLBCL-kkel szemben, amelyek mind az NF-κB, mind a STAT3 jelátviteli utaktól függenek (Lyu et al., 2010a, b) és kitűnő kitűnő lehet a klinikai fejlődéshez (Wen et al., 2011).
EUS a gyomor-daganatok értékelésében
Thomas Rösch,. Shyam Varadarajulu, endoszonográfiában (második kiadás), 2011
Diffúz nagy B-sejtes limfóma
A DLBCL korábban magas minőségű MALT lymphoma néven ismert. A DLBCL-ben szenvedő betegek általában előrehaladottabb stádiumú betegségben szenvednek, és súlyos szisztémás tüneteik vannak, például a hasi fájdalom, a gyomornyúlás elzáródása, a vérzés vagy a perforáció. 56, 57 A felső endoszkópia nagy, többszörös fekélyeket vagy kiálló izofitikus daganatokat fedezhet fel. A szisztolikus vizsgálatok összefutó lapokat vagy nagysejtű klasztereket mutatnak, amelyek központi blasztokat vagy immoblasztokat mutatnak. 58 Ezek a tumorok citogenetikailag, biológiailag és klinikailag különböznek a MALT lymphomától, és rosszabb prognózissal rendelkeznek. A kifejezés magas minőségű MALT lymphoma kerülni kell a DLBCL-hez, mert ez nem megfelelő kezeléshez vezethet. Bár az EUS segíthet meghatározni a daganat penetrációjának mélységét a gyomor falában, a lokális staging önmagában kevésbé hatásos, tekintettel a betegség terjedelmére és a multimodalitás kezelésére, amely részt vesz e betegek gondozásában.
A módosított Egészségügyi Világszervezet limfómák osztályozásának összefoglalása (2008) 40
Klinikai jellemzők és patológia a helyszínek bemutatásakor
A diffúz nagyméretű B-sejtes limfóma, amely másképp nincs feltüntetve (DLBCL, NOS) körülbelül 30% NHL-t tartalmaz. A bemutatás lehet csomó-alapú vagy extranodális betegség. 40 A betegek harminc százaléka B-tüneteket (láz, fogyás, éjszakai izzadás) a diagnózis idején. A prognosztikai tényezők értékelése fontos a terápiához; ilyen tényezők közé tartozik az életkor, a betegség állapota, a teljesítőképesség állapota és a szérum laktát-dehidrogenáz (LDH) koncentrációja. Az alacsony kockázatú betegek 83% -os 5 éves túléléssel rendelkeznek, míg az 5 éves túlélés csak 32% a magas kockázatú betegségben. 40 A DLBCL, NOS esetek többsége felmerül de novo de jelentős arány a kis B-sejtes limfóma (különösen a B-sejtes CLL és FL) variánsai következtében vagy azok kíséretében történik.
A DLBCL által infiltrálva a NOS általában a teljes nyálkahártya-szerkezet teljes vagy közel teljes elvesztését okozza, és nagy robbanássejtekkel helyettesíti. Leggyakrabban ezek középpontok, de az immunoblasztok és a plazmablasztok változó aránya jelen lehet. A beszivárgó sejtek lehetnek monotonok vagy kimutatható pleomorfizmus; esetenként a Reed-Sternberg sejtjeivel hasonlító anaplasztikus sejtek találhatók. A DLBCL, NOS esetek is előfordulnak de novo extranodális helyeken, különösen a GI rendszer, a herék és a csont bevonásával. Jelenleg nem tisztázott, hogy a primer extranodális megjelenéssel rendelkező DLCBL variánsok kórokozóan kapcsolódnak-e az alacsony fokú csomópontú vagy extranodális lymphomákhoz. A központi idegrendszerben és a mediastinumban jelentkező nagy B-sejtes limfómák elkülönülten ismertek fel a WHO osztályozásának 2008-as felülvizsgálatában, ami azt bizonyítja, hogy ezek megkülönböztető klinikopatológiai egységek.
Hodgkin-limfóma és nem-Hodgkin-limfóma
Diffúz nagy B-sejtes limfóma
A DLBCL a gyermekgyógyászati lymphomák 10% -át teszi ki. Kevésbé gyakori a kisgyermekek körében, és gyakoribb a serdülőknél. A DLBCL a perifériás limfoid szervek transzformált érett B-sejtjeiből származik. 100 DLBCL tumorban olyan sejtek vannak, amelyek 4-5-ször kisebbek a kis limfociták méretének. A felnőtteknél genetikai aláírás van; a gyermekek esetében ez azonban nem így van. A tumorok expresszálják a c-MYCMint a BL, valamint az NF kappa-béta útvonalak génjei, de a DLBCL specifikus markere nincs. A tumorok CD19, CD20, CD22 és CD79a expresszálódnak. A három leggyakoribb morfológiai változat centroblasztikus, immunoblasztikus és anaplasztikus. A gén-expressziós profilozás két altípusot azonosított: a B-sejt-szerű (GC) és az aktivált B-sejt (ABC). A leggyakoribb altípus, a GC, kedvezőbb eredményt hoz. A megjelenés legáltalánosabb módja a fokozatosan bővülő tömeg. A tünetek a tumor helyén alapulnak. A gyermekkori DLBCL körülbelül 20% -a mediastinalis anyagként jelenik meg, de a daganatok bárhol előfordulhatnak. A fokozott laktát-dehidrogenáz (LDH), pleura effusions és ascites kevésbé megfigyelhető, mint más NHL-ben. A csontvelő (BM) és a központi idegrendszer (CNS) ritkán fordulnak elő. 87
Nyirokcsomók
Paul E. Wakely, Edmund S. Cibas, Cytology (harmadik kiadás), 2009
Diffúz nagy B-sejtes limfóma
A DLBL egy agresszív, de potenciálisan keményíthető altípus az NHL-ben, amely a felnőtt lymphomák 35% -át teszi ki. Ez egyike a gyermekek három fő lymphomájának. Az extranodális betegségben szenvedő betegek kb. 40% -a. Érdemes megemlíteni a DLBL klinikailag különálló változatait. A mediastinum primer DLBL dominanciája fiatal felnőtt nőknél és kiváló vena cava obstrukciót okozhat. Az FNA-t sikeresen alkalmazták ennek a változatnak a diagnosztizálásában, 34, 98, de a szklerózis korlátozhatja az FNA mintavételét néhány figyelemreméltó sejtre. Két másik változat a primer effúzió nagy B-sejtes limfóma (lásd a 4. fejezetet) és az intravaszkuláris nagy B-sejtes limfóma (lásd a 14. fejezetet).
A DLBL szövettani jellemzője a nagy malignus B-sejtek összefolyó területeinek jelenléte. Számos morfológiai altípust ismertek (centroblasztikus, immunoblasztikus, T-sejtes vagy histiocyte-gazdag, anaplasztikus nagy B-sejt és mások), de az alosztályozás nem klinikailag releváns. 99 A gén expressziós profilján keresztül azonosították a DLBL-csírasejtközponti B-sejt-szerű, aktivált B-sejt-szerű és a 3-as típusú genetikai altípusokat. 100 Ezek klinikai jelentőséggel bírnak abban az értelemben, hogy megjósolják a túlélést a kemoterápia után. Előzetes bizonyítékok arra utalnak, hogy a génexpressziós profilalkotás elvégezhető az FNA-kon. 41
A bcl-2 gén átrendeződést az esetek 30% -ában találjuk. 90 További 30% -uk a 3q27 régió abnormalitását mutatja be a bcl-6-mal.
A DIFFÚZIÓBB B-CELL LYMPHOMA CYTOMORFOLÓGIA:
túlnyomórészt nagy sejtek (2,5-5-szerese a kis limfocita méretének). Altípusok: •
háttérben gazdag kis méretű limfocitákban (T-sejtek) vagy histiocitákban
változó számú tingible-body makrofágok
dendritikus-limfocita aggregátum hiánya vagy hiánya
A DLBL-ből származó kenetek cellularitása változó. A mediastinális DLBL aszpirátumai ritkán cellulárisak lehetnek a tumoroknál gyakori szklerózis következtében. A DLBL legtöbb FNA-je legalábbis mérsékelten sejtes, és a kenetek általában könnyen felismerhetők abnormálisnak, mivel nagy atipikus sejtek vannak (11.23 ábra). Kerek vagy nagyon szabálytalan nukleuszos maggal rendelkezhetnek, és csekély citoplazmával (centroblastic típus); egy kerek vagy szabálytalan mag, egyetlen kiemelkedő nukleolussal és bőven citoplazmával (immunoblaszt típusú); vagy egy furcsa, pleomorf sejt, amelynek gyakori multinukleációja hasonlít az RS-sejtek magjára (anaplasztikus típus). A kisméretű, nem-neoplasztikus T-sejtek populációja mindig jelen van, de általában a sejtmintának kisebb részét képviseli. Bizonyos esetekben azonban a kisméretű T-sejtek, a histiocitákkal együtt, meghaladják a nagy, neoplasztikus B-sejteket (T-sejt vagy hisztiocyta gazdag típus).
A DLBL FCM általi jellemzése kihívást jelenthet mind azért, mert a nagy, atipikus sejtek a szokásos “limfoid kapuján” kívül jelenhetnek meg az FCM szétszóródásokon és azért, mert a sejtek nem élnek túl a feldolgozással a törékenység miatt. Ezekben az esetekben a klónosság PCR-vel történő meghatározása szükséges.
Diffúz nagy B-sejtes limfóma
A DLBCL agresszívabb limfóma a follikuláris lymphomához képest. A DLBCL fogalmát egyetlen betegségként először megkérdőjelezték, amikor a génexpressziós profilalkotás során kimutatták, hogy a DLBCL legalább két különálló, különböző génkifejezéssel és klinikai viselkedéssel rendelkező alcsoportot tartalmazott. Ezeket az alcsoportokat germinális-központú B-sejtek (GCBs) és aktivált B-sejt-szerű B-sejtek (ABC-k) neveztük el, a normál GC B-sejtekből és a normál post-GC B-sejtekből származó GC-sejtekből származó GCB-ként. A betegek ezen alcsoportjai közötti túlélés szignifikáns különbséget mutatott, a teljes túlélés öt éve 76% a GCB és 16% az ABC DLBCL betegeknél (Alizadeh et al., 2000). Ezeket a különbségeket számos további vizsgálatban megerősítették (Rosenwald et al., 2002; Wright et al., 2003). Ezek a entitások számos más jellemzővel rendelkeznek, mint például az MHC II. Osztályú génexpresszió.
A GCB DLBCL alcsoport számos korábban azonosított onkogén eseményt mutatott, beleértve a t (14; 18) transzlokációt, amely a BCL2 gén, túlzott expressziója C-REL a 2p kromoszómából, valamint a LMO2. Ezek az események nem voltak jelen az ABC alcsoportban (Rosenwald et al., 2002). A GCB gén expressziós aláírása (Alizadeh et al., 2000) azt sugallja, hogy a GCB DLBCL sejtek normál GC B-sejtekből származnak (Dave és munkatársai, 2004), és számos normál GC B-sejt biológiai jellemzőit mutatják. Például ezek a tumorok számos G2 / M fázisú mediátorral és alacsonyabb metabolikus génekkel, így pl. MYC (Shaffer és munkatársai, 2001). A GCB aláírásából három gén áll a legerőteljesebb módon a túléléshez (BCL6, SERPINA9, és GCET2) (Rosenwald et al., 2002; Staudt és Dave, 2005). Genetikai szinten a miR17-92 és az alléles veszteségeket érintő példányszám-nyereséget PTEN specifikusan kapcsolódtak a GCB altípushoz (Lenz et al., 2008).
A DLBCL-k ABC-alcsoportjának rosszindulatú sejtjei olyan poszt-germinális-központú B-sejtekből származnak, amelyek meggátolják a plazmasejtek differenciálódását. Az ABC DLBCL-t meghatározó gén expressziós alanyok génjei a plazma-sejtek differenciálódásával járnak, a fehérjék és immunglobulinok magas szekréciójával. Az ABC altípushoz kapcsolódó genetikai változások közé tartozik az ismert tumorszuppresszor deléciója INK4a/ARF, és a triszómiát 3 (Lenz és munkatársai, 2008). A GCB DLBCL-től eltérően, amelyek kifejezik BCL6, a DLBCL-ek ABC-alcsoportja túlexpresszálódik IRF4, amely általában az antigén megjelenését követően fokozza a sejtosztódást, de folyamatosan aktívvá válik a DLBCL kifejlesztésében (Alizadeh et al., 2000). A gének PRKCB1 és PDE4B mint a GCB DLBCL (Staudt és Dave, 2005).
A DLBCL harmadik különálló altípusa, az úgynevezett primer mediastinalis B-sejtes limfóma (PMBL), amely az egyéb altípusokkal átfedésben van az LN-aláírás expressziójával és az NFκB aktivitásának növekedésével, és annak aláírása a génjeinek egyharmadát a Hodgkin-limfómát tükröző génexpressziós szignálhoz hasonlóan. A Hodgkin-betegség klinikai átfedése is volt, a legtöbb esetben fiatal nőknél mediastinalis betegségben fordultak elő, jobb ötéves általános túléléssel, mint a DLBCL (64 vs. 46%). Az a gén, amely legjobban képes megkülönböztetni a PMBL-t a többi DLBCL altípustól, az volt PDL2 (programozott halál ligand 2), amely a 9p kromoszómán helyezkedik el, és a Hodgkin limfóma is jellemző (Rosenwald et al., 2003a).
A DLBCL három meghatározott altípusai különböznek túlélési kimeneteleikben és terápiás válaszukban. A GCB, PMBL és ABC ötéves teljes túlélése 59%, 64% és 31% volt (Alizadeh et al., 2000; Rosenwald et al., 2002; Wright et al., 2003). Ezek a túlélési különbségek függetlenek voltak a génexpressziós profilok meghatározásához alkalmazott mikroarray-típustól (Wright et al., 2003). A GCB DLBCL általában jobb prognózist mutat, mint az ABC DLBCL, de jelentős eltérés mutatkozik az eredményben, a GCB-betegek 30% -os mortalitása a diagnózis két éve alatt, és az ABC DLBCL betegek körülbelül egynegyede még mindig életben van több mint tíz évvel a diagnózis felől . A DLBCL-ben prognosztikus génexpressziós szignálokat fejlesztettek ki, amelyek a GC B-sejteket, az LN-t, a proliferációt és az MHC II. Osztályt tükrözik, amelyek nagymértékben hatékonyak a prognosztizáló túlélésben ezen betegeknél (Rimsza et al., 2008).
A follikuláris limfómához hasonlóan a mikrokörnyezet és az immunválasz fontos a DLBCL-ben (Dave et al., 2004). Az előzőekben leírt aláírásokon kívül két, az 1. és a 2. sztromálként azonosított génexpressziós aláírások előre jelezték a CHOP vagy R-CHOP (rituximab kombinációját CHOP kemoterápiával kombinálva) kezelésre adott válaszreakciót (Lenz és munkatársai, 2008). A stromális 1 gén expressziós aláírás a fibronektin, osteonectin és kollagén felelős extracelluláris mátrix génjeit tartalmazza. A betegmintákban ezeknek a géneknek a termékeit találták a daganatsejtek, valamint a DLBCL biopsziák szövettani sejtjei közötti szálas szálakban. Úgy gondolják, hogy ez az aláírás egy monocita immunválaszt jelent a limfómasejtekre. A stromális 2 aláírás tartalmazza az endothelsejtek és az erek kialakulását. Ez összefüggésbe hozható klinikailag az aláírás magas expressziójával, ami növeli a véredény sűrűségét betegekben.
Ezek az adatok azt mutatják, hogy a DLBCL-ben a génexpressziós aláírások az e tumorok mögöttes biológiájának robusztus mérései, és új fényt keltettek a megfigyelt klinikai heterogenitás tekintetében.
B sejt lymphomák
Amer Wahed MD, Amitava Dasgupta PhD, DABCC, hematológia és koaguláció, 2015
Diffúz nagy B sejt lymphoma
A diffúz nagy B-sejtes limfóma (DLBCL) egy magas fokú lymphoma, amely a nagy neoplasztikus B-sejtek diffúz proliferációjával jár. Ez a leggyakoribb limfóma (a follicularis lymphoma a második leggyakoribb), és a felnőtt nem-Hodgkin-limfómák 30-40% -áért felelős. Gyorsan megnagyobbodó, gyakran tünetmentes tömeg jelenik meg egyetlen csomó / extranodális helyen. Az esetek 40% -ában kezdetben egy extranodális helyre korlátozódik. A csontvelő bevonása alacsony (az esetek 10% -ában) a diagnózis során. A csontvelő alacsonyabb fokú lymphomát (diszkordáns lymphoma) mutathat.
A DLBCL elsődleges vagy de novo, de lehet másodlagos a progresszióról / transzformációról más típusú lymphomából, beleértve az SLL (Richter transzformáció, az esetek 3,5% -át), a follicularis lymphoma (az esetek 25-33% -a), a marginális zóna limfóma, a nyirokcsomó limfocita domináns Hodgkin-lymphoma (NLPHL ) és LPL. A morfológiai változatok a következők:
Centroblastic: Kerek, hólyagos magok két-négy nukleollal
Immunoblasztikus: Központi nucleolus, basophil citoplazma
Anaplasztikus: nagyon nagy, sokszögű sejtek bizarr pleomorf magokkal; növekedhet kohéziós mintában, utánozva a karcinómát; általában CD30 +.
Az immunfenotipizálás általában pozitív B-sejtmarkerek, például CD20, CD22 és CD79a jelenlétét mutatja. A felszíni immunglobulinok (IgM> IgG> IgA) az esetek 50-75% -ában vannak jelen. A Bcl-2 marker az esetek kb. 30% -ában pozitív, de a pozitív Bcl-6-ot az esetek sokkal nagyobb százalékában figyeljük meg. A DLBCL esetek körülbelül 30% -a pozitív CD30-at mutat. A CD10 pozitivitás a follikuláris limfóma transzformációját jelenti. Az immunhisztokémiai alcsoportok a következők:
A germinalis centrum B sejtszerű (GCB): CD10 + (a sejtek több mint 30% -a) vagy a CD10 -, de a Bcl-6 +. Az MUM1 azonban negatív, és a nukleáris transzkripciós faktor-κB (NF-κB) aktiválása hiányzik.
Nongerminal centrum B-sejtszerű (más néven ABC típusú, ami az aktivált B-sejtet jelenti): Itt az NF-κB aktiválása pozitív.
A DLBCL különböző altípusai a 11.1. Az Epstein-Barr vírus tesztelése olyan betegeknél hasznos, akiknél a DLBCL gyanúja áll fenn a szöveti biopszia vizsgálata során. A biopsziás szövetekben az Epstein-Barr vírus által kódolt RNS transzkriptum (EBER) molekuláris detektálását a in situ a hibridizáció az arany standard annak igazolására, hogy egy hisztopatológiai elváltozás valóban Epstein-Barr vírus. Ezenkívül a látens membránfehérje 1 (LMP1) immunfestését is elvégezhetjük latens Epstein-Barr vírus kimutatására az érintett szövetekben [6].
11.10.1. B-sejtes limfóma, nem osztályozható jellemzőkkel A DLBCL és a Burkitt-lymphoma (szürke zónás lymphoma) közötti kölcsönhatás
Ezek a limfómák morfológiai és genetikai jellemzői mind a DLBCL, mind a Burkitt lymphoma esetében. A sejtek tipikusan nagy és kisebb sejtek keverékei. Csillogó ég lehet látni. A Ki-67 proliferációs index általában nagyon magas, körülbelül 90%. Ezeknek a limfómáknak némelyike bizonyítani tudja a “dupla hit” genetikai rendellenességeket, mind a Bcl-2, mind a MYC transzlokációkat.
Hasenclever nemzetközi prognosztikai eredményei
TV Ajithkumar, HM Hatcher, az Onkológiai Szakképzésben, 2011
A diffúz nagysejtes limfóma (DLBCL) az NHL 30% -át teszi ki, és agresszív klinikai viselkedés jellemzi a gyorsan nyúló lymphadenopathiával, amely gyakran jár együtt az extra nodális betegséggel.
Korai stádiumú betegségben kedvezőtlen tényezők nélkül (lásd a 21.6. Rovatot) a kezelés 3-4 ciklusú CHOP-val és rituximabbal (R-CHOP) kombinálva történik, majd részt vesz a terepen végzett sugárterápiával (30-35 Gy, 1,75-3 Gy / frakció) vagy 6-8 ciklus R-CHOP.
A korai stádiás betegségben szenvedő betegeket a kedvezőtlen tényezők és az előrehaladott betegségek kezelésére hasonlóan kezelik. A CHOP rituximabmal végzett kemoterápiája szignifikáns javulást eredményez a válaszadási arány, az eseménymentes és az általános túlélés tekintetében fiatal és idősebb betegeknél. A terjedelmes betegségben szenvedő betegek a legtöbbet a rituximab előnyben részesítik. A lokoregionális lokoterápiás radioterápia szerepe a terjedelmes területeken vagy az extra-csomó betegségben szenvedő betegeknél nem bizonyított. Ezzel a megközelítéssel a korai stádiumú betegség 5 éves túlélése 80-90%, a fejlett betegségeké pedig mintegy 50%.
A diffúz nagysejtes limfómában a központi idegrendszeri relapszus kockázati tényezői közé tartozik a koponya szerepe, egynél több nyirokcsomó megnyilvánulás (különösen a testis), az IPI> 1 és a csontvelő-infiltráció, ezért a CNS-profilaxist kell figyelembe venni.
Diffúz nagy B-sejtes limfóma
Faramarz Naeim,. Wayne W. Grody, a hematopathiás atlaszban, 2013
DLBCL, NOS az összes nem-Hodgkin-limfóma körülbelül 30% -át teszi ki. A medián életkor körülbelül 64 év. A férfi-női arány kissé> 1. A legtöbb beteg gyorsan növekvő tömeggel jelenik meg, általában a nyakon vagy a hasban. Az extranodális beavatkozás a betegek 40% -ánál jelentkezik, beleértve a gasztrointesztinális traktusokat, a bőrt, a központi idegrendszert, a csontot, a herétet, a májat, a lépet, a tüdőt és más szerveket. A betegek kb. 20% -a az 1. stádiumban van, és körülbelül 40% -a terjesztett betegséget mutat a diagnózis idején. A csontvelő bevonása az esetek 10-20% -ában fordul elő. A betegek mintegy 30% -a szisztémás “B” tüneteket mutat. A DLBCL-ek jelentős része a kevésbé agresszív limfómák, például CLL / SLL, LPL, SMZL, MALT lymphoma és FL transzformációjának eredménye.

Kommentek
Kommenteléshez kérlek, jelentkezz be: